Dolor neuropático posquirúrgico en traumatología
Postoperative neuropathic pain in traumatology
Resumen:
El dolor postoperatorio agudo no controlado o mal controlado es un potente predictor de aparición de dolor neuropático crónico posquirúrgico. El dolor crónico postoperatorio persistente es una entidad compleja cuya etiología no está del todo dilucidada, lo que afecta la calidad de vida de los individuos. El dolor crónico después de la cirugía suele ser, al menos en parte, neuropático, requiriendo su tratamiento un enfoque integral: biológico, psicológico y social. El dolor neuropático resultante de un trauma quirúrgico sigue siendo la expresión más común de esta entidad. El dolor neuropático posquirúrgico es un problema creciente debido al aumento y al envejecimiento de la población, a que se realizan cada vez más cirugías y a que se diagnostica más. Para su prevención es fundamental una adecuada analgesia perioperatoria y se recomienda utilizar siempre que sea posible técnicas que eviten el daño nervioso.
A pesar de los esfuerzos por comprender y seleccionar a los pacientes de riesgo, el manejo y la prevención de esta entidad son aún inadecuados.
La prevención es aquí también clave, como en otras facetas de la medicina, aplicándola de forma individualizada a los pacientes de riesgo.
Abstract:
Uncontrolled or poorly controlled acute postoperative pain is a strong predictor of the appearance of chronic neuropathic pain after surgery. Persistent chronic pain after surgery is a complex condition, with an aetiology that has still not been fully clarified, and which affects patient quality of life. Chronic pain after surgery is usually at least in part of a neuropathic nature, and its management requires an integral approach: biological, psychological and social. Neuropathic pain secondary to surgical trauma remains the most common expression of this condition. Postsurgical neuropathic pain is a growing problem due to the ageing of the population, the ever increasing number of surgeries performed, and the fact that the disorder is diagnosed more often. Its prevention requires adequate perioperative analgesia, and it is advisable to use techniques that avoid nerve damage whenever possible.
Despite the efforts to understand and select patients at risk, the management and prevention of this disorder remain inadequate.
As in other areas of Medicine, prevention here is a key aspect, with application on an individualised basis in patients at risk.
Definición
La nueva clasificación internacional de enfermedades (CIE-11) divide el dolor crónico en 7 grupos: dolor crónico primario, dolor crónico oncológico, dolor crónico posquirúrgico (DCPQ) o postraumático, dolor crónico neuropático, dolor orofacial y cefalea, dolor visceral crónico y dolor crónico musculoesquelético.
Tiene implicaciones médico-legales al separar entidades que, aunque puedan tener fisiopatología parecida, no la tienen etiológica (por ejemplo, el DCPQ y el dolor crónico postraumático)(1).
El DCPQ fue definido por primera vez en 1999 por Macrae y por Davis(2), y luego ampliado por Macrae(3) en 2001 como aquel “dolor que se desarrolla después de la intervención quirúrgica y dura al menos 2 meses”. Así pues, se entiende como DCPQ a aquel que persiste por encima de los 2 meses tras la intervención quirúrgica, excluyendo otras causas de dolor no relacionadas con la cirugía o su relación con un problema preexistente(3,4).
Werner y Kongsgaard(5) actualizaron en 2014 la definición de DCPQ o dolor posquirúrgico persistente : “Es el dolor que persiste al menos 3 meses después de la cirugía, que no estaba presente antes de la cirugía, o presenta características diferentes o un aumento de intensidad respecto al dolor preoperatorio, localizado en el sitio quirúrgico o en un área referida, excluyendo otras posibles causas del dolor (por ejemplo, recurrencia del cáncer, infección)”.
Si las características del dolor no cambian con respecto a las preoperatorias o si la gravedad disminuye debido a la cirugía, la afección no debe denominarse DCPQ.
Werner(5), por tanto, propone 5 puntos de actualización:
- El dolor se desarrolla después de un procedimiento quirúrgico o aumenta de intensidad después del procedimiento quirúrgico.
- El dolor debe tener una duración de al menos 3 a 6 meses y afectar significativamente la calidad de vida relacionada con la salud (CVRS).
- El dolor es una continuación del dolor agudo postoperatorio o se desarrolla después de un periodo asintomático.
- El dolor se localiza en el campo quirúrgico, se proyecta al territorio de inervación de un nervio situado en el campo quirúrgico o se refiere a un dermatoma (después de la cirugía en tejidos somáticos profundos o viscerales).
- Deben excluirse otras causas del dolor (infección o malignidad persistente en la cirugía del cáncer).
Según la CIE-11 el dolor neuropático es un “dolor urente o como una corriente eléctrica que se debe a trastornos metabólicos, nutricionales, infecciosos, genéticos, autoinmunitarios o vasculíticos. El dolor puede aparecer espontáneamente, sin provocación, o lo pueden provocar diversos estímulos nocivos o inocuos. Se trata del dolor característico de la neuropatía de fibras finas, pero incluso en las neuropatías de fibras gruesas, pueden verse afectadas suficientes fibras finas para causar dolor. El dolor neuropático suele afectar a las estructuras subcutáneas y a la piel de las partes acras. Puede ser un dolor constante o intermitente, y de tipo lacerante, urente o gélido.
El síndrome de dolor regional complejo (SDRC) sobreviene tras un traumatismo y se caracteriza por dolor regional, alteraciones sensitivas, distermias, actividad sudomotora, cambios de color cutáneos y edema (enlace de acceso a esta entidad en la CIE-11: http://id.who.int/icd/entity/1834504950).
Por otra parte, se considera dolor neuropático crónico al “dolor de larga duración provocado por una lesión o enfermedad del sistema nervioso somatosensitivo”. El dolor puede ser espontáneo o provocado y representa una reacción exagerada a un estímulo doloroso (hiperalgesia) o bien una reacción dolorosa ante un estímulo que normalmente no causa dolor (alodinia). El diagnóstico de dolor neuropático crónico requiere la presencia de antecedentes de lesión o enfermedad del sistema nervioso y una distribución del dolor que parezca plausible desde el punto de vista neuroanatómico. Los síntomas y signos sensitivos negativos (por ejemplo, la disminución o pérdida de la sensibilidad) y positivos (por ejemplo, la alodinia o la hiperalgesia) que apuntan a una afectación del sistema nervioso somatosensitivo deben ser compatibles con el territorio de inervación de la estructura nerviosa afectada(6) (enlace de acceso a esta entidad en la CIE-11: http://id.who.int/icd/entity/1170330671).
La característica más consistente asociada con la aparición de DCPQ es la duración del dolor postoperatorio agudo intenso. El dolor agudo posquirúrgico puede ser de 2 tipos, el dolor inflamatorio y el dolor neuropático(7). El dolor agudo puede provocar sensibilización central, reduciendo el umbral del dolor y aumentando la respuesta a los estímulos nocivos. Por lo tanto, el paciente puede presentar tanto hiperalgesia como alodinia(8).
Si se produce lesión de uno o más nervios durante la cirugía, aparecerá con frecuencia dolor de carácter neuropático, estableciéndose fenómenos de sensibilización periférica y sensibilización central, que cronificarán ese dolor, dando lugar a dolor neuropático crónico posquirúrgico(9). De hecho, la prevalencia del componente neuropático entre los distintos casos de DCPQ es variable según el tipo de cirugía, dependiendo de la probabilidad de lesión nerviosa yatrógena quirúrgica(10).
Epidemiología
Crombie(11) publica el primer artículo sobre DCPQ en 1998 y desde entonces básicamente se han publicado resultados sobre distintos tipos de intervenciones quirúrgicas.
Los procedimientos quirúrgicos con la mayor incidencia de DCPQ están asociados con daño nervioso intencional o no intencional, como amputación de extremidades, mastectomía y toracotomía posterolateral. La incidencia de dolor crónico tras estos procedimientos quirúrgicos oscila entre un 60 y un 70%, aproximadamente(12).
La incidencia informada de DCPQ varía para diferentes procedimientos quirúrgicos y en diferentes estudios, que van desde un mínimo del 5% hasta un máximo del 85%. Por ejemplo, del 50 al 85% después de la amputación de una extremidad, del 11 al 57% después de la mastectomía, del 30 al 55% después de una cirugía cardiaca, del 5 al 65% después de una toracotomía y del 5 al 63% después de una reparación de hernia inguinal(13).
Los estudios publicados respecto a procesos relacionados con traumatología han informado de incidencias que van del 50 al 85% después de la amputación de una extremidad o del 5 al 65% después de la toracotomía(13).
Aunque la gran mayoría de los individuos sometidos a una intervención quirúrgica recibe algún tipo de tratamiento analgésico, casi el 40% presenta dolor moderado a intenso en las primeras 24 horas del postoperatorio(14). Además, entre el 50 y el 75% no alcanza el alivio completo en el lapso de tiempo considerado normal(15).
Fletcher(16) en un estudio sobre pacientes quirúrgicos en Europa demostró que el 11,8% de los pacientes tiene dolor de moderado a intenso, mientras que el 2,2% tiene dolor intenso (escala visual analógica –EVA– ≥ 6) a los 12 meses después de la cirugía . La prevalencia del dolor crónico tras cirugía se estima del 10 al 50%(17). Puede ser intenso y limitante un año después de la cirugía, variando las tasas de un 2 a un 85%(18).
El infratratamiento del dolor conlleva morbilidad a corto plazo y además es un factor favorecedor de la cronificación(17).
Todo esto afecta sin duda a la calidad de vida del paciente, teniendo en cuenta que, además, el dolor tras una cirugía es considerado con frecuencia motivo de insatisfacción por parte del paciente, independientemente del resultado clínico(19).
El estudio de Fletcher(16) también encontró que la cirugía ortopédica se asocia con un riesgo casi 3 veces mayor de DCPQ de moderado a grave, en comparación con todos los demás procedimientos, a los 12 meses.
Dolor neuropático localizado (DNL)
Es un dolor neuropático periférico caracterizado por un área de dolor máximo consistente y circunscrita, de no más de un tamaño de hoja DIN-A4, asociado con sensibilidad anormal de la piel y/o síntomas espontáneos característicos del dolor neuropático(20,21).
La Asociación Internacional para el Estudio del Dolor (International Association for the Study of Pain –IASP–) lo define como un dolor causado por una lesión o enfermedad del sistema nervioso somatosensorial periférico, siendo el dolor espontáneo o evocado, como una mayor respuesta a un estímulo doloroso (hiperalgesia) o una respuesta dolorosa a un estímulo normalmente no doloroso (alodinia), aunque los síntomas o signos sensoriales negativos (por ejemplo, disminución o pérdida de sensibilidad) y positivos (por ejemplo, alodinia o hiperalgesia) que indican la afectación del sistema nervioso somatosensorial periférico deben ser compatibles con el territorio de inervación de la estructura nerviosa afectada, que en el caso de la cirugía puede seguir el trayecto de la herida, por lesión de inervación periférica local.
La base fisiopatológica de la cronificación de la neuropatía se debe a que un estímulo periférico mantenido en el tiempo provoca cambios plásticos a nivel periférico y medular. Por otra parte, el dolor neuropático incorpora componentes neuroinflamatorios, responsables del aumento del área de sensibilización periférica. La sensibilización (periférica y central) provoca una caída en el umbral del dolor y un aumento de la transmisión de información nociceptiva, perdiendo eficacia los sistemas de control endógenos, asociándose a cambios centrales y de reorganización cortical.
La prevalencia del DNL es de un 2% en la población general y de un 8% en pacientes de más de 55 años(22), representando además el DNL el 60% de todo el dolor neuropático(23).
Síndrome de dolor regional complejo
Actualmente, se consideran 2 tipos:
- SDRC de tipo I (antigua distrofia simpaticorrefleja). Según la nueva clasificación de la CIE-11, el SDRC de tipo I se desarrolla después de cualquier tipo de trauma, especialmente fractura de extremidad o lesión de tejido blando. El SDRC de tipo I no implica lesión nerviosa.
Los síntomas exceden en magnitud al curso clínico esperado tras el incidente inicial, producen deterioro motor importante y de progresión variable. El dolor, que puede ser espontáneo o provocado (alodinia o hiperalgesia), es siempre desproporcionado con el evento inicial y no sigue el trayecto neurológico de ningún nervio o raíz. Se acompaña de alteraciones vasomotoras y de la sudoración, distrofia cutánea y trastornos motores, sobre todo temblor fisiológico aumentado. - SDRC de tipo II (antigua causalgia). Según la nueva clasificación CIE-11, el SDRC de tipo II ocurre después de un traumatismo asociado con lesión de los nervios periféricos según lo indicado por el examen neurológico, las pruebas de electrodiagnóstico u otras pruebas cuasiobjetivas. Si bien las características clínicas de la lesión nerviosa (entumecimiento, parestesia) se limitan al territorio nervioso afectado, los signos y síntomas del SDRC deben extenderse más allá del territorio nervioso identificado. Los signos y síntomas de diagnóstico del SDRC de tipo I y del SDRC de tipo II son idénticos.
Fisiopatología
La capacidad de detectar estímulos nocivos es un mecanismo de protección de la mayoría de los organismos y es esencial para la supervivencia. Existen 2 tipos de dolor agudo postoperatorio: el dolor inflamatorio y el neuropático. El dolor inflamatorio es consecuencia de la liberación de mediadores inflamatorios locales como respuesta al estímulo doloroso. El dolor neuropático se produce tras lesión de los nervios o de los sistemas sensitivos de la médula espinal y del cerebro(7). Una lesión aguda, como una cirugía o un traumatismo, que provoca dolor crónico se asocia con cambios neuroplásticos en el sistema nervioso periférico y el central en respuesta a la entrada nociceptiva. Dichos cambios conducen a una hipersensibilidad del sistema nervioso que, a su vez, promueve la protección del área lesionada. La persistencia de estos cambios a menudo conduce a un dolor crónico debilitante. Así, el dolor de tipo inflamatorio se cronificará cuando se produce una reparación tisular incompleta. Una lesión estructural de un nervio deriva a dolor crónico con mayor probabilidad que el dolor producido por daño a tejidos somáticos(24). Tres procesos entrelazados pueden servir como objetivos para la prevención del dolor crónico e incluyen la sensibilización periférica, la sensibilización central y la modulación descendente(25).
Factores de riesgo
Se consideran diversos factores de riesgo(26), que se detallan a continuación.
Preoperatorios
- Severidad del dolor preoperatorio: Edgley(27) en 2019 observó que tras la cirugía en 326 pacientes traumáticos la mayor intensidad del dolor preoperatorio se asoció con dolor crónico, encontrándose este en el 65% de los casos.
- Factores psicológicos: pensamiento negativo precirugía, ansiedad, depresión, catastrofismo.
- Predisposición genética: por ejemplo, la subunidad alfa de los canales de potasio implicada en la excitabilidad neuronal. El holotipo del gen de la ciclooxigenasa 1 está asociado con menos dolor posterior a discectomía por dolor lumbar radicular persistente; también se correlaciona con la expresión de ARNm de los genes de transducción de señales(28).
- Sexo femenino(27).
- Cirugía previa(27).
- Edad avanzada (controvertido).
Intraoperatorios
- Tipo de anestesia: riesgo de lesión nerviosa en anestesias epidural, espinal o locorregional(29,30).
- Técnica quirúrgica: que conlleve corte, contusión, compresión, inflamación o lesión térmica o isquémica de un nervio. Daño tisular.
- Duración de la cirugía.
- Dolor intraoperatorio.
Postoperatorios
- Gravedad y duración del dolor postoperatorio: es la característica más constante asociada con la aparición de DCPQ.
- Radioterapia.
- Quimioterapia.
Dolor crónico y tipos de cirugía
Hay pocas publicaciones sobre DCPQ en cirugía ortopédica y traumatología, centrándose los primeros estudios en amputaciones (aparece en el 60%), prótesis de cadera, rodilla y, últimamente, de hombro.
En general, las cirugías realizadas sobre estructuras óseas y sobre articulaciones tienen prevalencias similares de DCPQ de alrededor del 20%(10).
Cirugía de cadera
Prótesis de cadera
MacWilliam(31) en 1996, en 848 cirugías de prótesis de cadera, encontró que factores como la raza, la educación, el número de comorbilidades y la puntuación del Cuestionario del Estado de Salud (Health Status Questionnaire –HSQ–) preoperatorio tienen un efecto sobre el dolor y la función física a los 6 meses de la operación. Se encontró que los pacientes con peores puntuaciones preoperatorias tenían peores puntuaciones postoperatorias. Por cada aumento de 10 puntos en la puntuación preoperatoria, los pacientes podrían esperar una disminución de al menos 6 puntos en la mejoría postoperatoria.
Así, el estado preoperatorio es un predictor importante del resultado de la prótesis de cadera. Se sabe que, en cirugía de prótesis de cadera, a más puntuación preoperatoria en la EVA, menos mejoría posquirúrgica hay.
Extracción de injerto autólogo de cresta ilíaca
La extracción de injerto de hueso ilíaco para cirugía resulta en una morbilidad significativa, incluyendo deterioro funcional, así como dolor intenso en el sitio de extracción en aproximadamente el 3% de los pacientes(32,33).
Cirugía de rodilla
El DCPQ con componente neuropático localizado se ha evidenciado en prótesis de rodilla o artroscopia de rodilla en frecuencia variable de un 11,4 hasta el 44,4%(34).
Prótesis de rodilla
Existe evidencia de que un 30% de los pacientes con artrosis sufren síntomas de sensibilización central(35,36).
Hochman(37) en 2011 sugería que un 25% de los pacientes con artrosis de rodilla presentan síntomas de dolor neuropático. Los pacientes con dolor intenso de más de 12 meses de evolución tienen peores resultados posquirúrgicos(38).
Fortin(39) en 1999, tras estudiar 220 prótesis articulares (incluyendo prótesis totales de cadera –PTC– y prótesis totales de rodilla –PTR–), sugiere que el mejor predictor del dolor y la función a los 6 meses después del reemplazo total de cadera o rodilla es el dolor y la función basales del sujeto. Además, la pérdida funcional avanzada debida a la artrosis de cadera o rodilla se asoció con un peor resultado a los 6 meses. Los pacientes con peor función preoperatoria permanecieron significativamente peor después de la operación. A peor función prequirúrgica, peor función posquirúgica.
Tras implantar una PTR existe una prevalencia de dolor crónico del 22 al 44%, considerándose neuropático hasta un 20% de los casos(40,41).
Recientes estudios de cohortes han encontrado similares resultados, con un 16 a un 33% de los pacientes refiriendo dolor crónico tras PTR(41).
Artroscopia de rodilla
Small(42) en 1998 recoge 4 casos de distrofia simpaticorrefleja (SDRC de tipo I) de 10.262 artroscopias realizadas.
Rosseland(43) en 2008 estimó que la prevalencia de dolor crónico después de una artroscopia de rodilla para ambos sexos ronda el 30%, siendo de carácter moderado o intenso en el 10% de los casos.
Cirugía de hombro
Desai et al.(44) en 2012 concluyen que el dolor preoperatorio y el dolor postoperatorio esperado son factores predictivos del dolor postoperatorio.
Artroplastia de hombro
Se han considerado factores predictivos de la cronificación del dolor posquirúrgico el tipo de diagnóstico, el tipo de prótesis, cirugías previas en el hombro, la edad y la valoración en la Short Form-36 Health Survey (SF-36) y en el cuestionario Disabilities of the Arm, Shoulder and Hand (DASH)(45).
Se ha observado una prevalencia del 22% de dolor crónico más allá de 1 a 2 años, existiendo del 4 al 13% dolor neuropático tras artroplastia de hombro; el dolor crónico es más frecuente tras fractura (29%) que tras artrosis (16%), mientras que la prevalencia de dolor neuropático se estima similar(46,47).
La mayor sensibilidad al dolor preoperatorio (umbral más bajo y mayor dolor en reposo) conlleva menos mejoría de la función y más dolor poscirugía(48).
Rotura del manguito
De Boer en 2019 aseguraba que los pacientes sometidos a cirugía de reparación del manguito rotador presentaban más dolor que los pacientes sometidos a otro tipo de cirugías en esa región anatómica, incluso que el sexo femenino y la descompresión subacromial con resección distal de la clavícula son significativos factores de riesgo en relación con intenso dolor posquirúrgico. Por ello, propone la idea de la necesidad de elaborar diferentes protocolos en función del tipo de paciente y del tipo de cirugía(49).
El control del dolor preoperatorio tiene relevancia clínica en pacientes sometidos a reparación artroscópica del manguito rotador(50).
Rizvi(51) concluye, en un estudio de cohortes en 2021, que la magnitud y la frecuencia del dolor preoperatorio son los factores más importantes para determinar el dolor postoperatorio tras cirugía artroscópica por rotura del manguito.
Un 15,8% de los pacientes con rotura completa del manguito rotador tienen dolor neuropático, estando relacionado con la EVA de las últimas 4 semanas y el mayor grado de rotura(52).
Prevención
La evidencia de la prevención es aún limitada: el beneficio a largo plazo de la analgesia preventiva-perioperatoria no se ha demostrado de manera consistente(8).
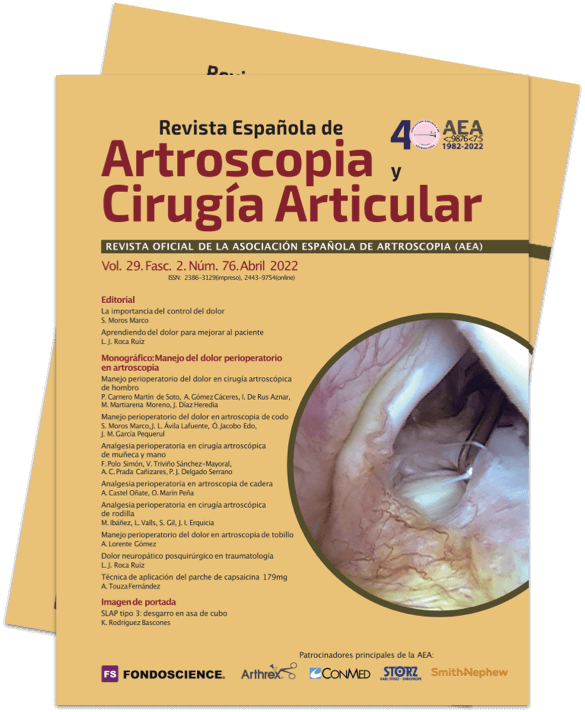
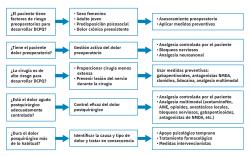
La prevención se aplica en 3 niveles (Figura 1): prequirúrgico, periquirúrgico y posquirúrgico(53).
Acciones prequirúrgicas
- Control del dolor preoperatorio: Karanikolas et al.(54) usaron una analgesia epidural perioperatoria optimizada en 65 pacientes que se sometieron a la amputación de un miembro inferior. La analgesia controlada por el paciente se inició 48 horas antes de la operación y continuó durante 48 horas después de la operación, en comparación con los pacientes que recibieron analgesia convencional y anestesia general. La incidencia de dolor del miembro fantasma después de 6 meses disminuyó significativamente.
- Disminuir la inflamación.
- Mejorar el hemograma.
- Controlar el sobrepeso.
- Aumentar el tono muscular.
- Controlar la ansiedad.
Acciones intraquirúrgicas
- Controlar la isquemia preventiva.
- Analgesia neuroaxial-bloqueos nerviosos periféricos. La adopción de analgesia preventiva (que proporciona control del dolor durante todo el periodo perioperatorio, bloqueando así el estímulo nocivo durante este periodo doloroso) en lugar de la analgesia intraoperatoria también ha mostrado beneficios en la prevención del DCPQ(55,56).
Un estudio comparó 3 técnicas analgésicas tras toracotomía: analgesia epidural torácica iniciada preoperatoria- e intraoperatoriamente (con analgesia epidural controlada por el paciente administrada postoperatoriamente en ambos casos), y analgesia intravenosa controlada por el paciente con morfina, iniciada postoperatoriamente. Se encontró que el DCPQ se redujo significativamente 6 meses después de la operación mediante el uso de la analgesia epidural torácica iniciada preoperatoriamente(57). - Incisión correcta. Se debe intentar en la medida de lo posible minimizar los abordajes extensos, minimizando el daño tisular. A pesar de esto, las cirugías artroscópicas no están exentas de causar DCPQ debido a una lesión en los nervios (por ejemplo, ramas del nervio safeno durante una artroscopia de rodilla), ya que esto no siempre se puede evitar debido a la proximidad de los nervios a la vía de abordaje o a la estructura ósea.
- Respeto a las partes blandas, abordaje preciso.
- Evitar el uso excesivo de bisturí eléctrico.
- Sierras en buen estado.
- Evitar la distracción excesiva de los distintos planos.
- Infiltrar intraoperatoriamente: las inyecciones intraarticulares de anestésicos locales durante la artroplastia y otras cirugías articulares pueden ser eficaces para lograr un mejor control del dolor postoperatorio. La infiltración de la herida con anestésicos locales tras la extracción de un injerto óseo de la cresta ilíaca provocó una disminución del dolor crónico del hueso ilíaco durante 4 años de seguimiento(33). Aun así, el resultado de la infiltración de la herida proporciona alivio breve, pero no afecta el riesgo de desarrollar dolor crónico(58).
- Experiencia del cirujano: los centros con cirujanos en formación suelen tener mayor incidencia de dolor crónico(59).
- Duración de la cirugía: las operaciones que duran más de 3 horas se asocian con un aumento del DCPQ(55,57).
- Control del dolor agudo intraoperatorio: la neuroplasticidad (sensibilización espinal) después de un traumatismo puede transformar un dolor agudo en dolor crónico si no se trata de manera oportuna. Esto se puede prevenir mediante un tratamiento exhaustivo del dolor agudo(33).
El uso de lidocaína intravenosa y crema perioperatoria EMLA redujo la incidencia de dolor crónico después de la mastectomía, sin tener un impacto significativo en los casos de dolor agudo(58).
Karanikolas(54) no encontró una diferencia en la incidencia de dolor fantasma crónico tras amputación con una analgesia epidural durante el periodo perioperatorio, en comparación con el uso de una analgesia opioide controlada por el paciente durante ese mismo periodo. Por tanto, un buen control del dolor a lo largo del periodo perioperatorio parece más importante que la técnica utilizada para lograr el control del dolor.
Lo mejor es el uso de analgesia multimodal durante el periodo perioperatorio para el tratamiento del dolor postoperatorio agudo(60). Los fármacos, al actuar por varios mecanismos, pueden controlar el dolor de forma más eficaz que utilizando un solo fármaco, ya que intervienen modulando las señales de dolor en varios puntos de la vía del dolor. Los regímenes de dolor multimodal pueden incluir combinaciones de gabapentina, antiinflamatorios no esteroideos (AINE), acetaminofén y anestesia regional con la técnica de analgesia convencional(60). Se han realizado muy pocos estudios en traumatología para evaluar los efectos de la analgesia multimodal sobre el DCPQ.
Acciones posquirúrgicas
- Control del dolor agudo postoperatorio: la intensidad y la persistencia del dolor agudo posquirúrgico es el factor predictivo que muestra una asociación más fuerte con la aparición de dolor crónico(29,61,62).
La persistencia del dolor postoperatorio pasadas las semanas 1.ª a 6.ª está relacionado con la presencia de DCPQ a los 3 meses de la intervención, aunque la incidencia va disminuyendo desde los 6 meses al año. Todo esto está relacionado con la sensibilización periférica y con la sensibilización central. - Movilización precoz (< 24 h).
- Detectar complicaciones.
Intervención psicológica
La depresión, la vulnerabilidad psicológica, el estrés y el regreso tardío al trabajo son factores de riesgo asociados al DCPQ(63). La catastrofización del dolor está relacionada a veces con una disminución del DCPQ, debido quizá a la búsqueda precoz de ayuda médica(12). Los pacientes que tienen creencias negativas sobre los opioides tienen un mayor riesgo de DCPQ(60).
La información preoperatoria adecuada, así como comentar las expectativas individuales, pueden aliviar el estrés y ayudar a prevenir el DCPQ. Por tanto, la actuación antes y después de la cirugía y la selección de pacientes vulnerables psicológicamente pueden ayudar a prevenir el dolor crónico(55).
Tratamiento farmacológico preventivo
Se han probado varios tratamientos para prevenir el dolor neuropático crónico posquirúrgico. Una revisión Cochrane(64) en 2013 publicó la evidencia en el tratamiento del DCPQ y concluía que: “Se necesitan pruebas adicionales de ensayos mejores, bien diseñados y a gran escala para evaluar de manera más rigurosa las intervenciones farmacológicas para la prevención del dolor crónico después de la cirugía. Además, la evidencia disponible no respalda la eficacia de gabapentina, pregabalina, antiinflamatorios no esteroides, esteroides intravenosos, bloqueadores de N-metil-D-aspartato (NMDA) orales, mexiletina oral, fentanilo intravenoso, lidocaína intravenosa, venlafaxina oral u óxido nitroso inhalado para la prevención del dolor postoperatorio”.
Posteriores estudios han ido posicionando el uso de los distintos fármacos.
Gabapentina y pregabalina
Mishriky(65) publica una revisión sistemática y un metaanálisis en los que la pregabalina perioperatoria se asocia con una significativa reducción del consumo de opioides después de la cirugía y redujo significativamente la incidencia de dolor a los 6 y a los 12 meses.
El resultado con gabapentina y pregabalina se considera que se debe al efecto analgésico preventivo proporcionado por los gabapentinoides(66). No obstante, una reciente revisión de 18 ensayos controlados aleatorios con estudios publicados y no publicados concluye, con evidencia moderada, que la pregabalina no podía reducir la incidencia de DCPQ a los 3 meses, aunque puede afectar a la incidencia del DCPQ con componente neuropático(67).
Antidepresivos
No se puede establecer ninguna conclusión respecto a la capacidad de prevenir el DCPQ, debido a lo heterogéneo de los estudios publicados. Wong(68) examinó 3 ensayos que utilizaron venlafaxina, duloxetina y escitalopram observando solo resultado positivo con venlafaxina. Koh(69) en 2019 concluye que la duloxetina perioperatoria podría mejorar la calidad de la recuperación y reducir el desarrollo de DCPQ en pacientes con sensibilización central preoperatoria.
Antagonistas de los receptores N-metil-D-aspartato
Se ha demostrado en diferentes estudios la utilidad del uso perioperatorio de una dosis subanestésica de ketamina para la prevención del dolor del miembro fantasma(25).
La ketamina parece ser el agente farmacológico con los resultados analgésicos preventivos positivos más consistentes(60). El uso perioperatorio de ketamina intravenosa ha demostrado su utilidad en la prevención, particularmente en procedimientos altamente dolorosos, como la cirugía ortopédica(70).
El uso de otros antagonistas NMDA, como la memantina, aún no se ha establecido, pero el alivio del dolor no parece mantenerse durante el tiempo suficiente para prevenir el DCPQ(25,55).
Agonistas alfa-2
Como la clonidina. Existen pocos estudios enfocados a la prevención del DCPQ, aunque podría tener un papel por sus efectos antiinflamatorios y antisensibilizantes(71).
Lidocaína
Usada como anestésico local para inyecciones perineurales, también su uso intravenoso está aumentando para el tratamiento del dolor crónico, así como perioperatorio para la reducción del dolor postoperatorio agudo. Una revisión Cochrane(64) en 2013 no pudo concluir sus efectos a este respecto. Posteriormente, en 2018 una nueva revisión concluye que la infiltración continua de la herida puede disminuir el DCPQ por extracción de injerto óseo de la cresta ilíaca(72). No obstante, se requiere más investigación antes de poder recomendar su uso en la prevención del DCPQ en otras áreas.
Antiinflamatorios no esteroideos
Aunque los AINE tienen un efecto beneficioso sobre el dolor agudo, ahorran opioides y se cree que reducen la hiperalgesia secundaria y la sensibilización central, sus efectos sobre la prevención del DCPQ no se han demostrado en ninguno de los múltiples estudios. El uso de ibuprofeno para la prevención del dolor crónico después de una cirugía de reemplazo de cadera no ha mostrado ninguna reducción significativa en la incidencia de DCPQ(73).
El papel del acetaminofén aún no se ha evidenciado, pues no se ha realizado ningún estudio controlado aleatorizado para mostrar su efecto en la prevención del DCPQ, aunque su uso es ahora una parte integral del manejo del dolor perioperatorio multimodal.
Reuben(74) estudió 200 pacientes sometidos a cirugía del ligamento cruzado anterior usando acetaminofén (1 g) y celecoxib frente a un placebo durante 1-2 horas antes de la operación junto con analgésicos intraarticulares y encontró que más pacientes en el grupo de control desarrollaron complicaciones femororrotulianas, incluyendo dolor anterior de rodilla y SDRC, entre otros, después de 6 meses de la cirugía. No obstante, más tarde (2009) se demostró que este estudio incluía datos fraudulentos.
Corticoides
Debido a su efecto antiinflamatorio y sabiendo que la instauración del dolor crónico implica neuroinflamación, podrían ser un agente prometedor para la prevención del DCPQ. Bergeron en 2009 no encontró diferencias en el DCPQ cuando se administraron 40 mg de dexametasona antes de una artroplastia total de cadera(75). Un estudio prospectivo, aleatorizado, de 1 año de seguimiento, del uso de 16 mg de dexametasona intravenosa después de la discectomía lumbar encontró una puntuación de dolor significativamente más alta para el grupo de dexametasona, aunque no hubo diferencias en la capacidad de trabajo, la discapacidad o la salud referida de los pacientes(76). El reciente metaanálisis de Zhu(77) estima que es probable que la administración de una dosis única de dexametasona por vía intravenosa antes de una PTR sea un tratamiento seguro y eficaz en cuanto a la reducción del dolor postoperatorio, el consumo de opiáceos y el riesgo de náuseas/vómitos postoperatorios.
Opioides
Los opioides son los analgésicos de elección para la analgesia intraoperatoria y postoperatoria para el dolor moderado a intenso y, dado que el dolor postoperatorio intenso es un factor de riesgo de DCPQ, pueden ayudar a prevenirlo. Un buen control del dolor con opioides es importante para la prevención del DCPQ, a pesar de su conocido riesgo de hiperalgesia (remifentanilo)(54).
Otros fármacos
Hay pocos estudios con dextrometorfano, mexiletina y óxido nitroso, y con efectos variables sobre el DCPQ(64). Así pues, no se puede recomendar el uso de estos medicamentos para la prevención del DCPQ.
Diagnóstico y diagnóstico diferencial
Son muy importantes, como siempre, una anamnesis y un examen físico detallados para filiar el tipo de dolor. Se debe hacer un diagnóstico diferencial con el dolor existente en el periodo preoperatorio, las complicaciones postoperatorias (entre las que destacan las infecciones) o la recurrencia de la enfermedad primaria.
Más del 50% de los pacientes con DCPQ tienen dolor neuropático y el resto tiene dolor nociceptivo (somático o visceral). Deben detallarse todos los componentes del dolor para un tratamiento correcto. Durante el preoperatorio y el postoperatorio temprano se debe informar al paciente sobre la posibilidad de desarrollar DCPQ. Y si el paciente lo padece, se debe informar al paciente y a sus familiares sobre su pronóstico, el plan de tratamiento y su rehabilitación. Debe implicarse a los pacientes en las estrategias de autocuidado y de regreso a su actividad normal.
Tratamiento
Tratamiento no farmacológico
Cambios en el estilo de vida
Las terapias físicas (masajes, fisioterapia y acupuntura) pueden reducir el dolor, pero solo temporalmente. Todas estas terapias se deben realizar bajo el paraguas del no dolor o del dolor controlado.
No se recomienda reposo ni limitación de la actividad, ya que pueden contribuir a peores resultados funcionales(53).
Terapia psicológica
Tanto la terapia de conducta cognitiva (se basa en los principios del reforzamiento, centrándose en modificar las respuestas a las conductas desadaptativas y, en el caso del dolor crónico, las conductas que consisten en expresiones abiertas de dolor, angustia y sufrimiento)(78) como la terapia cognitiva conductual (no se centran en eliminar el dolor, sino en mejorar el funcionamiento físico y emocional a pesar del dolor)(79) son útiles en el manejo del DCPQ(80,81).
Brox(82) realizó en 2006 un estudio aleatorizado en pacientes con DCPQ después de una cirugía previa por hernia discal, comparando la efectividad de la fusión lumbar con fijación posterior con tornillos transpediculares frente a intervención cognitiva y ejercicios. La cirugía versus la combinación de intervención cognitiva y ejercicio mostraron niveles similares de efectividad en el manejo del dolor. Cohen(83) en 2002 publicó que el ejercicio intenso asociado a terapia cognitiva conductual es útil para mejorar el dolor de espalda en diversas patologías, incluido el posterior a la cirugía.
Tratamiento farmacológico
Hay pocos estudios de fármacos para el tratamiento del DCPQ sin componente neuropático y la mayoría de las recomendaciones se han extrapolado de los datos para otros tipos de dolor crónico, especialmente el dolor neuropático.
Así, se usan anticonvulsivos (gabapentina y pregabalina), antidepresivos tricíclicos (amitriptilina y nortriptilina), inhibidores de la recaptación de serotonina-noradrenalina (duloxetina y venlafaxina), lidocaína tópica o la primera línea de tratamiento con capsaicina tópica.
Paracetamol, AINE y opioides menores (tramadol y codeína) se pueden usar de acuerdo con la gravedad de los síntomas.
Los opioides mayores deben usarse con precaución, sopesando los riesgos y los beneficios. Otros fármacos que pueden resultar útiles son la ketamina, los relajantes musculares, la clonidina y la infusión intravenosa de lidocaína.
Una conclusión de una reunión de 44 especialistas en dolor de 17 países, basada en un análisis retrospectivo de informes de casos, concluyó que el DCPQ asociado con dolor localizado y superficial, y alodinia mostró una respuesta positiva al apósito de lidocaína al 5%(84).
Un estudio observacional de pacientes con DNL postraumático y posquirúrgico también mostró una reducción significativa del dolor y una disminución de las áreas dolorosas después del tratamiento con parche de lidocaína(85,86).
Parece prometedor el uso de amitriptilina tópica al 1% asociada a ketamina al 0,5% para el tratamiento del dolor neuropático, incluido el DCPQ(87).
Un estudio prospectivo abierto con una combinación de crema al 2% de amitriptilina y ketamina al 1%, aplicada durante 6-12 meses, mostró un alivio significativo del dolor, con satisfacción del paciente a largo plazo y efectos secundarios mínimos(88).
Tratamiento intervencionista
Se han considerado los bloqueos nerviosos, bloqueos neuroaxiales y simpatectomías.
Se observó alivio del dolor con inyecciones epidurales para el síndrome postoperatorio lumbar o cervical(89), pero solo fue efectivo con inyecciones de anestésicos locales y esteroides epidurales combinados, no aislados(90,91).
El bloqueo del plexo braquial axilar con analgesia controlada por el paciente es útil para el tratamiento del SDRC de tipo I desarrollado después de la liberación quirúrgica en el caso del síndrome del túnel carpiano(92).
Inyecciones de fenol o ablación por radiofrecuencia en el neuroma y los ganglios de la raíz dorsal son útiles para el dolor del muñón y del miembro fantasma(93,94).
Si otras opciones fallan, se ha encontrado útil la coagulación de la zona de entrada de la raíz dorsal (dorsal root entry zone –DREZ–) y la estimulación del cordón motor. También tiene utilidad la rizotomía parcial percutánea por radiofrecuencia, la radiofrecuencia pulsada de los ganglios de la raíz dorsal con los del nervio intercostal. La radiofrecuencia ablativa y pulsada, la estimulación nerviosa eléctrica transcutánea y la terapia en espejo pueden proporcionar beneficios en pacientes con síndrome del miembro fantasma(95).
La estimulación de la médula espinal ha proporcionado resultados prometedores en el dolor del miembro fantasma(96). También es eficaz para el tratamiento del dolor neuropático de miembros superiores o inferiores después de cirugías cervicales o espinales, y en el SDRC de tipo I(17).
Tratamiento quirúrgico
No hay información relevante en cirugía ortopédica ni en traumatología. Basándonos en publicaciones sobre otras áreas de la cirugía, la resección quirúrgica del neuroma y la retracción del nervio en planos musculares parece de utilidad en pacientes posmastectomía(97). Reubicar el nervio a un sitio protegido y ayudar a que pueda crecer mediante un injerto también puede ser útil(94,95).
Asimismo, un injerto de grasa autólogo en la unión dermohipodérmica en el área de la cicatriz dolorosa es eficaz(98).
La escisión de una cicatriz en la hernia inguinal también puede ayudar a aliviar el dolor después de la cirugía, así como la retirada de material (malla)(99).
Tras estas cirugías, no es descartable la recurrencia del DCPQ; por tanto, son fundamentales las medidas preventivas, incluyendo el tratamiento y la información perioperatoria eficaz del dolor. Estas referencias basadas en otras áreas en las que se produce lesión nerviosa nos pueden servir de guía y animar a realizar estudios específicos en traumatología.
Son necesarios equipos interprofesionales para enfocar de forma multidisciplinaria el complejo proceso de la cronificación del dolor posquirúrgico con alta incidencia de dolor neuropático, que incluye no solo factores biológicos, sino psicosociales(100,101).
Conclusiones
Podemos concluir que se requieren estudios prospectivos a gran escala con evaluaciones multifactoriales pre-, intra- y postoperatorias detalladas para perfeccionar la comprensión de la etiología y el pronóstico del DCPQ(8).
Actualmente, ante el escaso conocimiento del tratamiento efectivo, actuar sobre los factores de riesgo podría mejorar la incidencia de DCPQ, como esquematizó Thapa(53) en 2018. La prevención individualizada en pacientes de alto riesgo de cronificación podría incrementar el éxito de las medidas preventivas.
Para la evaluación y el manejo adecuados de esos factores de riesgo son necesarios equipos interprofesionales, para caracterizar la experiencia del dolor postoperatorio de cada paciente y examinar el dolor que surge durante su actividad funcional. Por otra parte, es importante detectar cuánto componente inflamatorio y cuánto neuropático presenta el DCPQ, orientando así el tratamiento multimodal.
Información del artículo
Cita bibliográfica
Autores
Luis Javier Roca Ruíz
Unidad de Hombro. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Virgen Macarena. Sevilla
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de interés.
Financiación. Este trabajo ha sido financiado con la ayuda de Grünenthal.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Margarit C. La nueva clasificación internacional de enfermedades L (CIE-11) y el dolor crónico. Implicaciones prácticas. Rev Soc Esp Dolor. 2019;209-10.
-
2Macrae W, Davis HTO. Chronic Post-surgical Pain. En: Crombie IK, Linton S, Croft P, Von Korff M, LeResche L (eds.). Epidemiology of pain. Seattle: IASP Press; 1999. pp. 125-42.
-
3Macrae WA. Chronic pain after surgery. Br J Anaesth. 2001;87(1):88-98.
-
4Glare P, Aubrey KR, Myles PS. Transition from acute to chronic pain after surgery. Lancet. 2019;393(10180):1537-46.
-
5Werner MU, Kongsgaard UE. Defining persistent post-surgical pain: Is an update required? Br J Anaesth. 2014;113(1):1-4.
-
6The Lancet. Icd-11. Lancet. 2019;393(10188):2275.
-
7Ribera H, Esteve N, Garrido JP. La transición de dolor agudo postoperatorio a crónico: ¿Qué sabemos? Rev Soc Esp Dolor. 2012;19(4):197-208.
-
8Bruce J, Quinlan J. Chronic post surgical pain 2010-Searle-12-4. Rev Pain. 2011;5(3):23-9.
-
9Torres LM, Gálvez R. Dolor neuropático periférico localizado. Asociación Andaluza del Dolor; 2017.
-
10Haroutiunian S, Nikolajsen L, Finnerup NB, Jensen TS. The neuropathic component in persistent postsurgical pain: a systematic literature review. Pain. 2013;154(1):95-102.
-
11Crombie IK, Davies HTO, Macrae WA. Cut and thrust: antecedent surgery and trauma among patients attending a chronic pain clinic. Pain. 1998;76(1-2):167-71.
-
12Katz J, Seltzer Z. Transition from acute to chronic postsurgical pain: risk factors and protective fa. Expert Rev Neurother. 2009;9(5):723-44.
-
13Schug SA, Pogatzki-Zahn EM. Chronic pain after surgery or injury. International association for the study of pain. Pain. 2011;19(1):19.
-
14Ong CKS, Seymour RA. Pathogenesis of Postoperative Oral Surgical Pain. Anesth Prog. 2003;50(1):5-17.
-
15Schecter WP, Bongard FS, Gainor BJ, Weltz DL, Horn JK, General SF. Pain Control in Outpatient Surgery. J Am Coll Surg. 2002 Jul;195(1):95-104.
-
16Fletcher D, Stamer UM, Pogatzki-Zahn E, et al. Chronic postsurgical pain in Europe: an observational study. Eur J Anaesthesiol. 2015;32(10):725-34.
-
17Shipton E. Post-surgical neuropathic pain. ANZ J Surg. 2008;78(7):548-55.
-
18Macrae WA. Chronic post-surgical pain: 10 Years on. Br J Anaesth. 2008;101(1):77-86.
-
19Montaner MC, Soler E, Faus MT. El dolor postoperatorio en la actualidad: un problema de calidad asistencial. Farm Hosp. 2000;24(3):118-75.
-
20Mick G, Baron R, Finnerup NB, et al. What is localized neuropathic pain? A first proposal to characterize and define a widely used term. Pain Manag. 2012 Jan;2(1):71-7.
-
21Lara-Solares A, Mayoral-Rojals V, Guillén-Núñez MR, et al. Consenso multidisciplinario de diagnóstico y tratamiento del dolor neuropático periférico y localizado en México. Gac Med Mex. 2019;155(4):428-35.
-
22Martyn CN, Hughes RAC. Epidemiology of peripheral neuropathy. J Neurol Neurosurg Psychiatry. 1997;62(4):310-8.
-
23Plancarte-Sánchez R, Samano-García M, Guillén-Núñez M del R, Equihua-Ortega A. Dolor neuropático localizado. Gac Med Mex. 2021;157(3):9-11.
-
24Velasco M. Dolor neuropático. Rev Med Clin Condes. 2014;25(4):625-34.
-
25McGreevy K, Bottros MM, Raja SN. Preventing chronic pain following acute pain: risk factors, preventive strategies, and their efficacy. Eur J Pain Suppl. 2011;5(2):365-76.
-
26Althaus A, Hinrichs-Rocker A, Chapman R, et al. Development of a risk index for the prediction of chronic post-surgical pain. Eur J Pain. 2012;16(6):901-10.
-
27Edgley C, Hogg M, de Silva A, Braat S, Bucknill A, Leslie K. Severe acute pain and persistent post-surgical pain in orthopaedic trauma patients: a cohort study. Br J Anaesth. 2019;123(3):350-9.
-
28Saxena AK, Chilkoti GT, Chopra AK, Banerjee BD, Sharma T. Chronic persistent post-surgical pain following staging laparotomy for carcinoma of ovary and its relationship to signal transduction genes. Korean J Pain. 2016;29(4):239-48.
-
29Perkins FM, Kehlet H. Chronic Pain as an Outcome of Surgery. Anesthesiology. 2000;93:1123-33.
-
30Lenters TR, Davies J, Matsen FA. The types and severity of complications associated with interscalene brachial plexus block anesthesia: local and national evidence. J Shoulder Elbow Surg. 2007;16(4):379-87.
-
31MacWilliam CH, Yood MU, Verner JJ, McCarthy BD, Ward RE. Patient-related risk factors that predict poor outcome after total hip replacement. Health Serv Res. 1996;31(5):623-38.
-
32Heary RF, Schlenk RP, Sacchieri TA, et al. Persistent iliac crest donor site pain: independent outcome assessment. Neurosurgery. 2002;50(3):510-7.
-
33Kraychete DC, Sakata RK, Lannes L de OC, Bandeira ID, Sadatsune EJ. Postoperative persistent chronic pain: what do we know about prevention, risk factors, and treatment. Braz J Anesthesiol. 2016;66(5):505-12.
-
34Pickering G, Martin E, Tiberghien F, Delorme C, Mick G. Localized neuropathic pain: an expert consensus on local treatments. Drug Des Devel Ther. 2017;11:2709-18.
-
35Akinci A, al Shaker M, Chang MH, et al. Predictive factors and clinical biomarkers for treatment in patients with chronic pain caused by osteoarthritis with a central sensitisation component. Int J Clin Pract. 2016;70(1):31-44.
-
36Arendt-Nielsen L, Nie H, Laursen MB, et al. Sensitization in patients with painful knee osteoarthritis. Pain. 2010;149(3):573-81.
-
37Hochman JR, Gagliese L, Davis AM, Hawker GA. Neuropathic pain symptoms in a community knee OA cohort. Osteoarthritis Cartilage. 2011;19(6):647-54.
-
38Jones CA, Voaklander DC, Johnston WC, Suarez-Almazor ME. The effect of age on pain, function, and quality of life after total hip and knee arthroplasty. Arch Intern Med. 2001;161(3):454-60.
-
39Fortin PR, Clarke AE, Joseph L, et al. Outcomes of total hip and knee replacement: Preoperative functional status predicts outcomes at six months after surgery. Arthritis Rheum. 1999;42(8):1722-8.
-
40Wylde V, Hewlett S, Learmonth ID, Dieppe P. Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. Pain. 2011;152(3):566-72.
-
41Wylde V, Beswick A, Bruce J, Blom A, Howells N, Gooberman-Hill R. Chronic pain after total knee arthroplasty. EFORT Open Rev. 2018 Aug;3(8):461-70.
-
42Small NC. Complications in arthroscopic surgery performed by experienced arthroscopists. Arthroscopy. 1988;4(3):215-21.
-
43Rosseland LA, Solheim N, Stubhaug A. Pain and disability 1 year after knee arthroscopic procedures. Acta Anaesthesiol Scand. 2008;52(3):332-7.
-
44Desai VN, Cheung E. Postoperative pain associated with orthopedic shoulder and elbow surgery: a prospective study. J Shoulder Elbow Surg. 2012;21(4):441-50.
-
45Simmen BR, Bachmann LM, Drerup S, Schwyzer HK, Burkhart A, Goldhahn J. Development of a predictive model for estimating the probability of treatment success one year after total shoulder replacement - cohort study. Osteoarthritis Cartilage. 2008;16(5):631-4.
-
46Razmjou H, Woodhouse LJ, Holtby R. Neuropathic pain after shoulder arthroplasty: prevalence, impact on physical and mental function, and demographic determinants. Physiother Can. 2018;70(3):212-20.
-
47Bjørnholdt KT, Brandsborg B, Søballe K, Nikolajsen L. Persistent pain is common 1-2 years after shoulder replacement: a nationwide registry-based questionnaire study of 538 patients. Acta Orthop. 2015;86(1):71-7.
-
48Kadum B, Inngul C, Ihrman R, Sjödén GO, Sayed-Noor AS. Higher preoperative sensitivity to pain and pain at rest are associated with worse functional outcome after stemless total shoulder arthroplasty: a prospective cohort study. Bone Joint J. 2018;100B(4):480-4.
-
49De Boer FA, Schouten TTJ, Boekestein EP, et al. Risk factors for postoperative pain in the first three weeks after arthroscopic or open shoulder surgery. Orthop Traumatol Surg Res. 2019;105(2):241-4.
-
50Tonotsuka H, Sugaya H, Takahashi N, Kawai N, Sugiyama H, Marumo K. Preoperative pain control in arthroscopic rotator cuff repair: Does it matter? CiOS Clinics in Orthopedic Surgery. 2019;11(2):192-9.
-
51Rizvi SMT, Bishop M, Lam PH, Murrell GAC. Factors Predicting Frequency and Severity of Postoperative Pain After Arthroscopic Rotator Cuff Repair Surgery. Am J Sports Med. 2021;49(1):146-53.
-
52Ko S, Choi C, Kim S, Chae S, Choi W, Kwon J. Prevalence and risk factors of neuropathic pain in patients with a rotator cuff tear. Pain Physician. 2018;21(2):E173-80.
-
53Thapa P, Euasobhon P. Chronic postsurgical pain: current evidence for prevention and management. Korean J Pain. 2018;31(3):155-73.
-
54Karanikolas M, Aretha D, Tsolakis I, Monantera G, Swarm RA, Filos KS. Optimized Perioperative Analgesia Reduces Chronic. Anesthesiology. 2011;114(5):1144-54.
-
55Reddi D. Preventing chronic postoperative pain. Anaesthesia. 2016;71:64-71.
-
56Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J. The prevention of chronic postsurgical pain using gabapentin and pregabalin: a combined systematic review and meta-analysis. Anesthesia Analgesia. 2012;115(2):428-42.
-
57Şentürk M, Özcan PE, Talu GK, et al. The effects of three different analgesia techniques on long-term postthoracotomy pain. Anesthesia Analgesia. 2002;94(1):11-5.
-
58Humble SR, Dalton AJ, Li L. A systematic review of therapeutic interventions to reduce acute and chronic post-surgical pain after amputation, thoracotomy or mastectomy. Eur J Pain. 2015;19(4):451-65.
-
59Tasmuth T, Blomqvist C, Kalso E. Chronic post-treatment symptoms in patients with breast cancer operated in different surgical units. Eur J Surg Oncol. 1999;25(1):38-43.
-
60Clarke H, Poon M, Weinrib A, Katznelson R, Wentlandt K, Katz J. Preventive analgesia and novel strategies for the prevention of chronic post-surgical pain. Drugs. 2015;75(4):339-51.
-
61Gotoda Y, Kambara N, Sakai T, Kishi Y, Kodama K, Koyama T. The morbidity, time course and predictive factors for persistent post-thoracotomy pain. Eur J Pain. 2001;5(1):89-96.
-
62Poleshuck EL, Katz J, Andrus CH, et al. Risk Factors for Chronic Pain Following Breast Cancer Surgery: A Prospective Study. J Pain. 2006;7(9):626-34.
-
63Hinrichs-Rocker A, Schulz K, Järvinen I, Lefering R, Simanski C, Neugebauer EAM. Psychosocial predictors and correlates for chronic post-surgical pain (CPSP) - A systematic review. Eur J Pain. 2009;13(7):719-30.
-
64Chaparro LE, Smith S, Moore RA, Gilron I. Pharmacotherapy for the Prevention of Chronic Pain after Surgery in Adults: review. Anesthesiology. 2021;(7):304-25.
-
65Mishriky BM, Waldron NH, Habib AS. Impact of pregabalin on acute and persistent postoperative pain: a systematic review and meta-analysis. Br J Anaesth. 2015;114(1):10-31.
-
66Schmidt PC, Ruchelli G, Mackey SC, Carroll IR. Perioperative gabapentinoids choice of agent, dose, timing, and effects on chronic postsurgical pain. Anesthesiology. 2013;119(5):1215-21.
-
67Martinez V, Pichard X, Fletcher D. Perioperative pregabalin administration does not prevent chronic postoperative pain: systematic review with a meta-analysis of randomized trials. Pain. 2017;158(5):775-83.
-
68Wong K, Phelan R, Kalso E, et al. Antidepressant drugs for prevention of acute and chronic postsurgical pain early evidence and recommended future directions. Anesthesiology. 2014;121(3):591-608.
-
69Koh I, Kim M, Sohn S, Song K, Choi N, In Y. Duloxetine Reduces Pain and Improves Quality of Recovery Following Total Knee Arthroplasty in Centrally Sensitized Patients: A Prospective, Randomized Controlled Study. J Bone Joint Surg Am. 2019;101(1):64-73.
-
70McNicol ED, Schumann R, Haroutounian S. A systematic review and meta-analysis of ketamine for the prevention of persistent post-surgical pain. Acta Anaesthesiol Scand. 2014;58(10):1199-213.
-
71Van de Ven TJ, John Hsia HL. Causes and prevention of chronic postsurgical pain. Curr Opin Crit Care. 2012;18(4):366-71.
-
72Weinstein EJ, Levene JL, Cohen MS, et al. Local anaesthetics and regional anaesthesia versus conventional analgesia for preventing persistent postoperative pain in adults and children. Cochrane Database Syst Rev. 2018;2018(4).
-
73Fransen M, Anderson C, Douglas J, et al. Safety and efficacy of routine postoperative ibuprofen for pain and disability related to ectopic bone formation after hip replacement surgery (HIPAID): randomised controlled trial. Br Med J. 2006;333(7567):519-21.
-
74Reuben SS, Ekman EF. The effect of initiating a preventive multimodal analgesic regimen on long-term patient outcomes for outpatient anterior cruciate ligament reconstruction surgery (Retraction in: Anesth Analg. 2009 Apr;108(4):1350). Anesth Analg. 2007;105(1):228-32.
-
75Bergeron SG, Kardash KJ, Huk OL, Zukor DJ, Antoniou J. Perioperative dexamethasone does not affect functional outcome in total hip arthroplasty. Clin Orthop Relat Res. 2009;467(6):1463-7.
-
76Nielsen RV, Fomsgaard J, Mathiesen O, Dahl JB. The effect of preoperative dexamethasone on pain 1 year after lumbar disc surgery: a follow-up study. BMC Anesthesiol. 2016;16(1):1-9.
-
77Zhu M, Chang Y, Phillips S, Scholey A, Bhandari M. Preoperative Single-Dose Intravenous Dexamethasone for Total Knee Arthroplasty: A Systematic Review and Meta- Analysis. Orthoevidence. 2022;5(3).
-
78Patterson DR. Behavioral methods for chronic pain and illness: a reconsideration and appreciation. Rehabil Psychol. 2005;50(3):312-5.
-
79Turk DC, Meichenbaum D, Genest M. Pain and Behavioral Medicine: A Cognitive-Behavioral Perspective. New YorK, NY: Guilford; 1983.
-
80Eccleston C. Role of psychology in pain management. Br J Anaesth. 2001;87(1):144-52.
-
81Turk DC, Audette J, Levy RM, Mackey SC, Stanos S. Assessment and treatment of psychosocial comorbidities in patients with neuropathic pain. Mayo Clin Proc. 2010;85(3 Suppl.):S42-50.
-
82Brox JI, Reikerås O, Nygaard Ø, et al. Lumbar instrumented fusion compared with cognitive intervention and exercises in patients with chronic back pain after previous surgery for disc herniation: A prospective randomized controlled study. Pain. 2006;122(1-2):145-55.
-
83Cohen I, Rainville J. Aggressive exercise as treatment for chronic low back pain. Sports Med. 2002;32(1):75-82.
-
84Nicolaou A, Nicholson B, Hans G, Brasseur L. Outcome predictors for treatment success with 5% lidocaine medicated plaster in low back pain with neuropathic components and neuropathic pain after surgical and nonsurgical trauma. J Pain Res. 2011;4:25-38.
-
85Correa-Illanes G, Roa R, Piñeros JL, Calderón W. Use of 5% lidocaine medicated plaster to treat localized neuropathic pain secondary to traumatic injury of peripheral nerves. Local Reg Anesth. 2012;5(1):47-53.
-
86Hans G, Joukes E, Verhulst J, Vercauteren M. Management of neuropathic pain after surgical and non-surgical trauma with lidocaine 5% patches: study of 40 consecutive cases. Curr Med Res Opin. 2009;25(11):2737-43.
-
87Lynch ME, Clark AJ, Sawynok J. A pilot study examining topical amitriptyline, ketamine, and a combination of both in the treatment of neuropathic pain. Clin J Pain. 2003;19(5):323-8.
-
88Lynch ME, Clark AJ, Sawynok J, Sullivan MJ. Topical amitriptyline and ketamine in neuropathic pain syndromes: an open-label study. J Pain. 2005;6(10):644-9.
-
89Abdi S, Datta S, Trescot AM, et al. Epidural steroids in the management of chronic spinal pain: a systematic review. Pain Physician. 2007;10(1):185-212.
-
90Manchikanti L, Singh V, Cash KA, Pampati V, Datta S. Management of pain of post lumbar surgery syndrome: one-year results of a randomized, double-blind, active controlled trial of fluoroscopic caudal epidural injections. Pain Physician. 2010;13(6):509-21.
-
91Manchikanti L, Malla Y, Cash KA, Mcmanus CD, Pampati V. Fluoroscopic cervical interlaminar epidural injections in managing chronic pain of cervical postsurgery syndrome: preliminary results of a randomized, double-blind, active control trial. Pain Physician. 2012;15(1):13-26.
-
92Wang LK, Chen HP, Chang PJ, Kang FC, Tsai YC. Axillary brachial plexus, block with patient controlled analgesia for complex regional pain syndrome type I: a case report. Reg Anesth Pain Med. 2001;26(1):68-71.
-
93Ganapathy S, Brookes J. Chronic postsurgical pain after nonarthroplasty orthopedic surgery. Tech Reg Anesth Pain Manag. 2011;15(3):116-23.
-
94Ramanavarapu V, Simopoulos TT. Pulsed radiofrequency of lumbar dorsal root ganglia for chronic post-amputation stump pain. Pain Physician. 2008;11(4):561-6.
-
95Subedi B, Grossberg GT. Phantom limb pain: mechanisms and treatment approaches. Pain Res Treat. 2011;2011:864605.
-
96Manchikanti L, Singh V. Managing phantom pain. Pain Physician. 2004;7(3):365-75.
-
97Wong L, Bartlett SB. Intercostal neuromas: a treatable cause of postoperative breast surgery pain. Ann Plast Surg. 2001;46(5):481-4.
-
98Caviggioli F, Maione L, Forcellini D, Klinger F, Klinger M. Autologous fat graft in postmastectomy pain syndrome. Plast Reconstr Surg. 2011;128(2):349-52.
-
99Hakeem A. Current trends in the diagnosis and management of post-herniorraphy chronic groin pain. World J Gastrointest Surg. 2011;3(6):73.
-
100Clarke H, Woodhouse LJ, Kennedy D, Stratford P, Katz J. Strategies aimed at preventing chronic post-surgical pain: Comprehensive perioperative pain management after total joint replacement surgery. Physiother Can. 2011;63(3):289-304.
-
101Cregg R, Anwar S, Farquhar-Smith P. Persistent postsurgical pain. Curr Opin Support Palliat Care. 2013;7(2):144-52.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La importancia del control del dolor
- Aprendiendo del dolor para mejorar al paciente
- Manejo perioperatorio del dolor en cirugía artroscópica de hombro
- Manejo perioperatorio del dolor en artroscopia de codo
- Analgesia perioperatoria en cirugía artroscópica de muñeca y mano
- Analgesia perioperatoria en artroscopia de cadera
- Analgesia perioperatoria en cirugía artroscópica de rodilla
- Manejo perioperatorio del dolor en artroscopia de tobillo
- Dolor neuropático posquirúrgico en traumatología
- Técnica de aplicación del parche de capsaicina 179 mg
- SLAP de tipo 3: desgarro en asa de cubo
Más en PUBMED
Más en Google Scholar


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.