Todo lo que nos puede aportar la impresión ósea en 3D
Introducción
La impresión en 3 dimensiones (3D), también llamada manufactura por adición, es un tipo de fabricación asistida por computadora (CAM) que se originó a finales de los años setenta, aunque no fue hasta los años ochenta, con las patentes de estereolitografía, cuando se empezó a consolidar su desarrollo(1).
El concepto principal de la impresión 3D es generar piezas o modelos por deposición de capas superpuestas para generar un volumen tridimensional; para esto se utilizan diferentes tecnologías:
- Manufactura por deposición fundida (FDM). En esta técnica se usa un material termoplástico que suele almacenarse en un rollo de filamento. Una punta extrusora se ocupa de fundir el material y depositarlo capa por capa a una temperatura inferior para que solidifique rápidamente.
- Solidificación mediante luz óptica (SLA). Técnica más rápida en la que se proyecta una imagen completa sobre un material viscoso (habitualmente una resina), generando una capa de una vez al solidificar el material que entra en contacto con la luz.
- Sinterización mediante láser óptico (SLS). Técnica similar a la FDM pero mucho más precisa en la que un láser solidifica un material que suele disponerse en polvo capa sobre capa.
- Sinterización directa de metal por láser (DMLS). Evolución de la SLS aplicada a la impresión 3D con metales(2).
El diseño final lo genera un software que facilita a la impresora la ubicación tridimensional o coordenada de cada partícula o píxel. La unión de cada una de estas partículas en los respectivos planos y la superposición de estos genera un objeto con un volumen 3D sólido y manipulable. Podemos decir que, dadas las posibilidades actuales, si somos capaces de crear un modelo digital con un software de diseño asistido por computadora (CAD), podemos imprimirlo en 3D.
Una de las primeras citaciones bibliográficas que encontramos de modelos impresos en 3D en pie y tobillo es también una de las primeras publicaciones en el campo de la cirugía ortopédica. Windisch y Salaberger publicaron un artículo en 2007 donde explican cómo obtuvieron diferentes modelos tridimensionales de pies equinovaros para comprender y definir mejor la compleja anatomía y la deformidad de sus pacientes(3).
Una primera reflexión que podemos extraer de este artículo es que disponer de un modelo tridimensional manipulable nos va a permitir una mejor comprensión de estructuras complejas. Esto cobra especial interés en el pie y el tobillo, donde encontramos en un área relativamente reducida múltiples carillas articulares dispuestas en diferentes planos espaciales asociadas a huesos cortos, lo que complica la orientación espacial en comparación con otras zonas anatómicas del sistema musculoesquelético. Un reflejo de la utilidad que supone para los cirujanos ortopédicos la impresión 3D de modelos anatómicos se puede extrapolar del número de publicaciones relacionadas con este campo. Desde la investigación de Windisch y Salaberger, el número de publicaciones ha crecido de forma exponencial. Si analizamos las publicaciones de 2020, podemos encontrar una media de 3 publicaciones mensuales relacionadas con el pie y el tobillo.
Un segundo elemento importante de la impresión de modelos en 3D es: ¿cómo puedo extrapolar la anatomía de mi paciente a un software de diseño digital que me permita formar un modelo tridimensional digital? Como hemos comentado antes, el software necesita formar un sistema de coordenadas para asignar en las diferentes capas los píxeles que van a formar la silueta. Las imágenes DICOM de la tomografía computarizada (TC) y la resonancia magnética nuclear (RMN) nos ofrecen esta información y en los últimos años se han desarrollado múltiples programas para convertir estas imágenes en modelos digitales(4).
Denominamos técnicamente “segmentación” al proceso de extrapolación de imágenes DICOM a un modelo digital tridimensional. Aunque inicialmente se usó la TC para realizar las segmentaciones de estructuras óseas y sigue siendo la técnica más frecuentemente utilizada, la tecnología actual nos permite segmentar imágenes DICOM de RMN para generar modelos 3D de estructuras óseas con unos resultados equiparables a la TC(5). Un aspecto importante en la segmentación son las características con las que se realiza el estudio de diagnóstico por la imagen; estas van a determinar la definición y la precisión del modelo tridimensional final. Estas características se han ido depurando y actualmente podemos encontrar protocolos bien definidos para cada zona anatómica u órgano/estructura a estudiar(6).
Una vez generado un modelo anatómico impreso en 3D, vamos a poder darle diferentes usos. En los últimos años, la docencia, la práctica quirúrgica, la planificación preoperatoria y el diseño de implantes quirúrgicos han sufrido una revolución gracias a la suma de las diferentes tecnologías que hemos mencionado en esta introducción.
Aunque no profundizaremos en ello en este capítulo, la fabricación de ortesis plantares, de pie y tobillo, prótesis de sustitución para amputaciones parciales e incluso piezas específicas de prótesis completas para amputaciones mayores se ha visto beneficiada e implementada gracias a la impresión 3D(7,8).
Impresión de modelos anatómicos 3D en la docencia
Desde hace muchos años, en parte por las dificultades de acceso al material cadavérico, las preparaciones anatómicas tratadas para su conservación han ido desplazando a las piezas en fresco para la disección directa por los alumnos. Una de las limitaciones de estas preparaciones es la de vernos condicionados por la anatomía específica de cada espécimen, así como su largo y laborioso proceso de preparación. Por estos motivos, dentro de los diferentes centros docentes y facultades, era muy complejo poder disponer de modelos cadavéricos que mostraran variantes de la normalidad o patologías poco frecuentes. La impresión 3D ha permitido obtener modelos anatómicos a un coste reducido, mejorando la docencia y minimizando la infraestructura necesaria para disponer de un catálogo amplio y fidedigno de la anatomía humana(9).
Este último punto ha permitido que no solo en las facultades de medicina, sino también en servicios o unidades específicas de hospitales o clínicas, se pueda disponer de una gran variedad de modelos, muchas veces réplicas de patologías de la práctica clínica diaria, para mejorar la formación de los estudiantes, los residentes o el personal sanitario en general. Particularmente en cirugía ortopédica, la relativa facilidad para disponer del modelo anatómico de un caso real permite tanto la comprensión de deformidades complejas, como la práctica de diferentes técnicas quirúrgicas como pueden ser las osteotomías correctoras(10).
Una figura que solemos olvidar en la docencia médica es el propio paciente. Muchas veces nos resulta complicado explicarles su problema de forma entendible. Teniendo en cuenta que no disponen de nociones de anatomía, hacerles entender la base de su patología y el objetivo del tratamiento supone una tarea ardua, en la que no siempre conseguimos escapar de tecnicismos y argot médico. Esta comprensión parcial de su problema y de la solución que se les ofrece les genera una incertidumbre que suele afectar negativamente a la satisfacción con los resultados. El uso de modelos 3D no solo mejora los resultados de la cirugía, sino que facilita hacerles entender mejor a nuestros pacientes su problema y la solución que hemos planificado, mejorando la comunicación y su valoración en las escalas de satisfacción(11).
Impresión de modelos anatómicos 3D en la planificación preoperatoria
Las fracturas complejas del pie y el tobillo o las deformidades complejas suponen un reto de abstracción para el cirujano, que muchas veces debe hacerse mentalmente una representación tridimensional de ellas basada en las diferentes imágenes que ofrecen las pruebas diagnósticas como la RMN y la TC en el plano sagital, axial y coronal. Como hemos comentado previamente, disponer de un modelo tangible permite identificar los defectos y trazos de fracturas, así como las desviaciones axiales, de forma rápida.
La comprensión de la deformidad o fractura supone el primer punto de la planificación preoperatoria. Escoger la indicación quirúrgica adecuada o la vía de abordaje va a repercutir favorablemente en el tiempo y los resultados de la cirugía(12). Pero los modelos impresos en 3D no son solo un elemento estático de observación y estudio; manipularlos, reducir los diferentes fragmentos, calcular y realizar las osteotomías correctoras, así como aplicar el material de osteosíntesis sobre el modelo ya modificado, nos va a permitir practicar y simular la cirugía “en frío”(13). Ya disponemos de estudios con grado de evidencia A que determinan una reducción del tiempo quirúrgico de casi el 20%, así como reducciones estadísticamente significativas del sangrado intraoperatorio y del tiempo de fluoroscopia(14).
En nuestra experiencia personal, la impresión de modelos anatómicos en 3D ha resultado crucial para el tratamiento de las deformidades por neuroartropatía de Charcot en pacientes afectos de pie diabético. La gran destrucción articular y la alteración de la anatomía han convertido los modelos tridimensionales en una prueba diagnóstica de rutina para comprender las deformaciones de estos pacientes y planificar sus cirugías, siendo una de las primeras referencias bibliográficas al respecto el artículo de Giovinco y Dunn en 2012. Nosotros llevamos a cabo esta práctica desde 2016(15).
Dentro de todo el proceso de tratamiento, usamos el modelo 3D en diferentes fases. En la fase preoperatoria nos permite calcular y practicar las osteotomías correctoras necesarias en pacientes sin osteomielitis. En los pacientes con patología séptica se realiza un desbridamiento radical del hueso afecto en función del estado intraoperatorio; en este caso, el modelo 3D, junto con el resto de las pruebas complementarias, nos permite orientar de forma aproximada cuál será el remanente óseo y su posición final. También en la fase preoperatoria y en función del modelo final una vez realizadas las correcciones oportunas, realizamos el diseño y el montaje del fijador externo circular de tipo Ilizarov®, incorporándolo montado y esterilizado al quirófano. Este paso nos permite evitarnos el tiempo intraoperatorio de ensamblado que, dependiendo del caso, podía suponer un 25% del tiempo quirúrgico total.
En la segunda fase, durante el acto quirúrgico, la gran destrucción articular y la deformidad de estos pacientes supone de nuevo un reto en el momento de realizar el abordaje e identificar las diferentes estructuras osteoarticulares; en esta fase, esterilizamos el modelo original para poderlo manipular y palpar dentro del campo, lo que nos facilita reconocer las diferentes relaciones anatómicas, identificar nuestra posición y reducir de nuevo el tiempo quirúrgico y el tiempo de fluoroscopia.
Tras varios años de experiencia, actualmente usamos el modelo anatómico impreso en 3D para explicar al paciente su patología, definir la indicación quirúrgica y como referencia anatómica intraoperatoria. El resto de las funciones descritas, como la planificación preoperatoria, la simulación de las osteotomías y correcciones osteoarticulares, así como el diseño del fijador externo circular, las llevamos cabo digitalmente con un software adecuado. Esto nos ofrece la ventaja de poder rediseñar las correcciones tantas veces como queramos sin depender de un modelo físico cada vez.
Implantes metálicos hechos a medida y su aplicación a la cirugía
En los últimos años, con los avances en tecnología aditiva, ha surgido un interés creciente por la medicina personalizada. La realización de implantes metálicos a medida es una realidad cada vez más habitual en algunas especialidades como la cirugía maxilofacial o la neurocirugía. Sin embargo, en cirugía ortopédica y traumatología (COT), su utilización actual es excepcional. Aunque la causa de esto es multifactorial, el precio de este tipo de implantes, sumado a la poca accesibilidad al conocimiento especializado necesario para su desarrollo, son puntos determinantes.
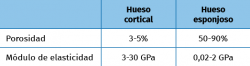
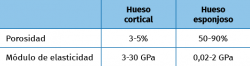
El objetivo principal de un implante metálico hecho a medida debe ser el de resolver el defecto óseo de una forma precisa y lo más anatómicamente posible, ofreciendo además unas características biomecánicas y de osteointegración lo más similares al hueso humano, tanto de la parte esponjosa como de la cortical. Sin embargo, ambas partes difieren mucho en porosidad y módulo de elasticidad (Tabla 1), dificultando el diseño y la fabricación(16). Además, hay que tener en cuenta otros factores, como la rugosidad y la capacidad de osteointegración, ya que la primera jugará un papel clave en la estabilidad primaria inicial de la reconstrucción y la segunda en la supervivencia a medio-largo plazo del implante. Para conseguir mayor osteointegración no solo será determinante controlar el grado de porosidad y distribución de los poros, sino también el tamaño de los mismos. Sin embargo, existe controversia sobre el tamaño ideal, ya que mientras unos autores defienden tamaños de entre 100 y 400 µm(17), otros han demostrado que poros de mayor tamaño (entre 600 y 900 µm) muestran mayor y más rápido crecimiento óseo que poros de 300 µm(18). Que exista interconexión entre los distintos poros es algo que también favorece la osteointegración.
Las potenciales aplicaciones de esta tecnología en COT van desde la cirugía tumoral o séptica hasta los recambios de prótesis de revisión con importantes defectos óseos. Concretamente en cirugía de pie y tobillo, esta tecnología se ha desarrollado mayoritariamente para la fabricación de astrágalos a medida tras talectomías generalmente secundarias a necrosis avascular(19,20), aunque también se ha utilizado puntualmente en casos de cirugía tumoral(21,22). Personalmente, tuvimos ocasión de utilizar la tecnología aditiva para el tratamiento de una osteomielitis crónica de tobillo. Según nuestro conocimiento, no existen precedentes en la literatura de la utilización de esta tecnología tras una infección osteoarticular de tobillo.
Aplicación práctica a través de un caso
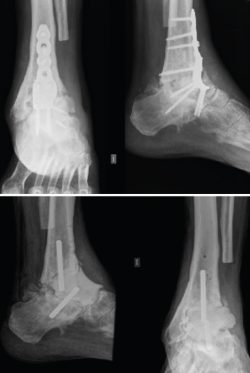
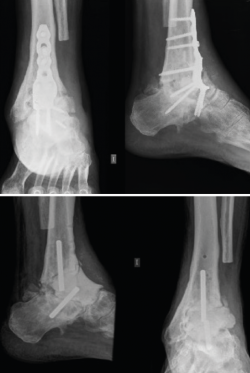
Para ejemplificar la aplicabilidad de la tecnología 3D, expondremos en este capítulo un caso realizado por los autores. Se trata de un enfermo de 63 años que consulta por infección crónica del tobillo izquierdo. Presentaba antecedentes de 10 cirugías previas en dicho tobillo. En el momento de la consulta, era portador de una placa de osteosíntesis con tornillos (Figura 1) y presentaba dos fístulas productivas.
Dado el grado de afectación, se decidió plantear una cirugía en 2 tiempos. En el primer tiempo se realizó ablación de todo el material de osteosíntesis, resección en bloque del foco de pseudoartrosis y del tejido infectado, y tratamiento antibiótico específico durante 8 semanas. La cavidad fue rellenada con un espaciador de cemento hecho a mano. Para aportar mayor estabilidad del montaje, se añadieron 2 tetones metálicos recubiertos de cemento con antibiótico (Figura 1). Precisamente el espaciador fue usado como referencia inicial para el diseño del implante definitivo que sería implantado en el segundo tiempo. Para ello, se realizó una TC y se creó un equipo multidisciplinar entre varios cirujanos de pie y tobillo, y los ingenieros de la empresa fabricante. El implante en cuestión debía rellenar de forma anatómica todo el defecto, pero además debía permitir el paso de un clavo de artrodesis estándar que estabilizara el montaje hasta que se produjera su osteointegración.
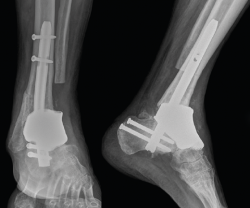
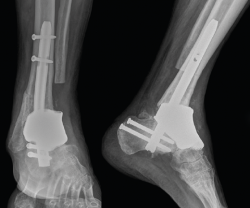
Tras varias simulaciones, se decidió imprimir en resina los modelos anatómicos pre- y postosteotomías, así como las guías de corte para realizar una simulación de la cirugía de segundo tiempo (Figura 2). Una vez validado por el equipo quirúrgico, se procedió a la impresión del implante en titanio. Se mantuvo la porosidad de todas aquellas partes que fueran a estar en contacto con el hueso del paciente, mientras que el resto de las zonas fueron pulidas para conseguir una superficie lisa que evitara potenciales adherencias tendinosas (Figura 3).
Tras la cirugía, se mantuvo al paciente en descarga durante 2 meses para posteriormente y con ortesis realizar carga progresiva. Tras 4 años de seguimiento, el paciente deambula sin ayudas externas, no refiere dolor y no existen signos radiológicos (Figura 4), analíticos ni clínicos de infección.
Pese a que se trata de un caso aislado, el éxito obtenido a corto-medio plazo nos anima a seguir utilizando esta tecnología en futuros casos.
Tablas
Figuras
Figura 1. Arriba: radiografía con pseudoartrosis séptica con placa anterior; abajo: radiografía tras retirada de la placa y con espaciador de cemento con tetones.
Figura 2. Impresión en resina de los modelos anatómicos pre- y postosteotomías, así como las guías de corte para realizar una simulación.
Cita bibliográfica
Autores
Jorge Román Verdasco
Unidad de Pie y Tobillo. Complex Hospitalari Moisès Broggi. Sant Joan Despí, Barcelona
Servicio de Cirugía Ortopédica y Traumatología. Unidad de Tobillo y Pie. Hospital Universitari Vall d’Hebron. Barcelona
Consorci Sanitari Integral. Hospitalet de Llobregat, Barcelona
Lluis Font Vizcarra
Unidad de Pie y Tobillo. Hospital Universitari Clínic. Barcelona
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Mútua Terrasa. Barcelona
Daniel Poggio Cano
Servicio de Cirugía Ortopédica y Traumatología. Unidad de Cirugía de Pie y Tobillo. Hospital Clínic i Provincial. Barcelona
Institut Clínic de l'Aparell Locomotor (ICAL)
Referencias bibliográficas
-
1Álvarez C, Carrillo JS, Fernández J, Grille C. Avances en equipamientos: la estereolitografía y sus materiales, un paso hacia el futuro. Cient Dent. 2006;3(2):151-6.
-
2Simchi A, Petzoldt F, Pohl H. On the development of direct metal laser sintering for rapid tooling. J Mater Process Technol. 2003;141(3):319-28.
-
3Windisch G, Salaberger D, Rosmarin W, Kastner J, Exner GU, Haldi-Brändle V, Anderhuber F. A model for clubfoot based on micro-CT data. J Anat. 2007 Jun;210(6):761-6.
-
4Marro A, Bandukwala T, Mak W. Three-Dimensional Printing and Medical Imaging: A Review of the Methods and Applications. Curr Probl Diagn Radiol. 2016 Jan-Feb;45(1):2-9.
-
5Stephen JM, Calder JD, Williams A, El Daou H. Comparative accuracy of lower limb bone geometry determined using MRI, CT and direct bone 3D models. J Orthop Res. 2020 Nov 22. Epub ahead of print.
-
6Materialise. Scan Protocols. Disponible en: https://www.materialise.com/en/resources/all/scan-protocols.
-
7Wojciechowski E, Chang AY, Balassone D, Ford J, Cheng TL, Little D, et al. Feasibility of designing, manufacturing and delivering 3D printed ankle-foot orthoses: a systematic review. J Foot Ankle Res. 2019 Feb 7;12:11.
-
8Xu R, Wang Z, Ren Z, Ma T, Jia Z, Fang S, Jin H. Comparative Study of the Effects of Customized 3D printed insole and Prefabricated Insole on Plantar Pressure and Comfort in Patients with Symptomatic Flatfoot. Med Sci Monit. 2019 May 12;25:3510-9.
-
9Inzunza O. 3D Impressions, New Technology that Supports Anatomical Teaching. Int J Morphol. 2015;33(3):1176-82.
-
10Wu AM, Wang K, Wang JS, Chen CH, Yang XD, Ni WF, Hu YZ. The addition of 3D printed models to enhance the teaching and learning of bone spatial anatomy and fractures for undergraduate students: a randomized controlled study. Ann Transl Med. 2018 Oct;6(20):403.
-
11Zheng W, Chen C, Zhang C, Tao Z, Cai L. The Feasibility of 3D Printing Technology on the Treatment of Pilon Fracture and Its Effect on Doctor-Patient Communication. Biomed Res Int. 2018 Jan 18;2018:8054698.
-
12Misselyn D, Nijs S, Fieuws S, Shaheen E, Schepers T. Improved Interobserver Reliability of the Sanders Classification in Calcaneal Fractures Using Segmented Three-Dimensional Prints. J Foot Ankle Surg. 2018 May-Jun;57(3):440-4.
-
13Corona PS, Vicente M, Tetsworth K, Glatt V. Preliminary results using patient-specific 3d printed models to improve preoperative planning for correction of post-traumatic tibial deformities with circular frames. Injury. 2018 Sep;49 Suppl 2:S51-S59.
-
14Morgan C, Khatri C, Hanna SA, Ashrafian H, Sarraf KM. Use of three-dimensional printing in preoperative planning in orthopaedic trauma surgery: a systematic review and meta-analysis. World J Orthop. 2020 Jan 18;11(1):57-67.
-
15Giovinco NA, Dunn SP, Dowling L, Smith C, Trowell L, Ruch JA, Armstrong DG. A novel combination of printed 3-dimensional anatomic templates and computer-assisted surgical simulation for virtual preoperative planning in Charcot foot reconstruction. J Foot Ankle Surg. 2012 May-Jun;51(3):387-93.
-
16Bernard S, Grimal Q, Laugier P. Accurate measurement of cortical bone elasticity tensor with resonant ultrasound spectroscopy. J Mech Behav Biomed Mater. 2013 Feb;18:12-9.
-
17Itälä AI, Ylänen HO, Ekholm C, Karlsson KH, Aro HT. Pore diameter of more than 100 microm is not requisite for bone ingrowth in rabbits. J Biomed Mater Res. 2001;58(6):679-83.
-
18Taniguchi N, Fujibayashi S, Takemoto M, Sasaki K, Otsuki B, Nakamura T, et al. Effect of pore size on bone ingrowth into porous titanium implants fabricated by additive manufacturing: An in vivo experiment. Mater Sci Eng C Mater Biol Appl. 2016 Feb;59:690-701.
-
19Tracey J, Arora D, Gross CE, Parekh SG. Custom 3D-Printed Total Talar Prostheses Restore Normal Joint Anatomy Throughout the Hindfoot. Foot Ankle Spec. 2019 Feb;12(1):39-48.
-
20Kadakia RJ, Akoh CC, Chen J, Sharma A, Parekh SG. 3D Printed Total Talus Replacement for Avascular Necrosis of the Talus. Foot Ankle Int. 2020 Aug 18:1071100720948461.
-
21Scott DJ, Steele J, Fletcher A, Parekh SG. Early Outcomes of 3D Printed Total Talus Arthroplasty. Foot Ankle Spec. 2020 Oct;13(5):372-7.
-
22Fang X, Liu H, Xiong Y, Zhang W, Luo Y, Wu F, et al. Total talar replacement with a novel 3D printed modular prosthesis for tumors. Ther Clin Risk Manag. 2018 Oct 5;14:1897-905.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Introducción
- Generalidades, técnicas innovadoras: presente y futuro
- Todo lo que nos puede aportar la tomografía axial computarizada en carga en los problemas del pie y el tobillo
- Todo lo que nos puede aportar la tomografía computarizada dinámica
- Todo lo que nos puede aportar la impresión ósea en 3D
- Todo lo que nos puede aportar la impresión de implantes-guías quirúrgicas en 3D
- Todo lo que nos puede aportar la impresión de tejidos blandos en 3D
Más en PUBMED
Más en Google Scholar


La Monografía de Actualización de la SEMCPT está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.