Papel del cirujano vascular en el pie diabético
Introducción
La prevalencia mundial de diabetes en 2017 fue de unos 451 millones de personas y se estima que en 2045 llegará a 693 millones según la International Diabetes Federation(1). De estos pacientes, alrededor de un 6,4% de media padecerán un pie diabético. Aproximadamente la mitad de estos pacientes tienen a su vez una enfermedad arterial periférica(2). En nuestro medio en concreto y según el estudio Eurodiale son un 41% los pacientes en los que coexisten ambas patologías(3). De este 41% de pacientes en Europa solo a un 53% se les ha practicado algún tipo de estudio vascular. Esto nos da una idea tanto del volumen del problema como de lo infradiagnosticado que está.
Un diagnóstico incorrecto de la enfermedad arterial periférica puede tener consecuencias serias. Los datos del Eurodiale, tal y como hemos comentado, muestran que un 47% de los pacientes con pie diabético y arteriopatía no tienen ningún tipo de estudio vascular; esta es una situación de riesgo, ya que hoy en día algunos autores han demostrado que la demora en el tratamiento de pacientes con úlcera diabética y afectación vascular disminuye la probabilidad de curación de la herida(4). En concreto, una demora de más de 8 semanas en el tratamiento de la isquemia desde que el paciente se valora y se considera como apto para revascularización empeora claramente el pronóstico final de la extremidad afecta. Por esta razón, desde el primer momento nuestros esfuerzos deben ir asociados al correcto diagnóstico de la enfermedad arterial periférica.
En cuanto a los costes que representa esta patología, en los Estados Unidos de América el coste por paciente con pie diabético y enfermedad arterial periférica es de unos 100.000 dólares(5) y en Europa de unos 9.851 € por paciente si no hay infección grave concomitante, mientras que si la hay, el coste por paciente se incrementa hasta los 16.835 €, que se dispara hasta 25.222 € en aquellos casos en los que se realiza una amputación mayor(6).
No queda claro hasta qué punto las unidades de pie diabético son capaces de reducir costes en estas situaciones, aunque parece razonable interpretar que un adecuado uso de los recursos probablemente permitirá optimizar los costes. Lo que sí se espera es que estas unidades reduzcan el número de amputaciones(7) y en parte esta disminución de las amputaciones será gracias al correcto diagnóstico de la isquemia y la revascularización de los pacientes(8).
Debemos tener en cuenta también que, debido al aumento de la supervivencia de la población general, esta población de pacientes es cada vez más anciana, de modo que presenta mayor morbilidad. Esta situación influye en una mayor gravedad de las lesiones en el momento del diagnóstico y en un peor pronóstico de salvamento de la extremidad pese a una correcta revascularización(8).
Por lo tanto, debemos estar preparados para diagnosticar correctamente el problema y sobre todo en un ámbito en el que los pacientes, debido a sus comorbilidades, edad, falta de sensibilidad…, no perciben la situación que están viviendo como algo potencialmente peligroso para ellos.
Diagnóstico de la enfermedad arterial periférica
Una primera aproximación en el diagnóstico de estos pacientes es sencilla y barata. Todo el personal sanitario que tiene una implicación directa en el tratamiento del pie diabético debería estar familiarizado con una exploración física mínima.
Es habitual leer que la microangiopatía diabética es una causa de úlcera vascular. Sin embargo, esta no debe ser considerada como la razón de una mala curación de una herida(9), ya que no hay evidencias que lo demuestren. Además, la microangiopatía isquémica es prácticamente indistinguible de la microangiopatía diabética, de modo que ante una enfermedad arterial periférica se considera que esta es la causa principal de la isquemia. Por esta razón es tan importante diagnosticarla correctamente.
En lo que se refiere a la exploración física, deben explorarse la presencia de pulsos periféricos y soplos, y alteraciones de las faneras como la pérdida de vello en los dedos de los pies u onicodistrofia. La palidez del pie en reposo o al elevar la extremidad desde el decúbito, así como una repleción capilar enlentecida deben ser exploradas tal y como recomiendan la mayoría de los autores y guías(2,9,10,11,12).
En relación con la sintomatología, uno de los aspectos que nos puede ayudar es la presencia de claudicación intermitente, que se presenta habitualmente como dolor en la pantorrilla que aparece con la deambulación y se manifiesta habitualmente tras caminar la misma distancia en las mismas condiciones, es decir, que no varía en función del día. Los pacientes son capaces de anticipar claramente cuándo les aparecerá el dolor al caminar en entornos con los que están familiarizados. Esto nos permite diferenciarlo claramente de otros dolores osteomusculares.
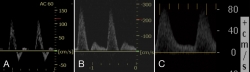
El Doppler continuo permite en algunos casos evaluar la morfología de la onda arterial de forma objetiva. Una onda trifásica descarta patología arterial(9), sobre todo si se acompaña de la palpación de pulso tanto tibial anterior como tibial posterior(10). La aparición de ondas bifásicas o monofásicas sugiere la presencia de arteriopatía periférica (Figura 1) y la presencia de ondas con flujo diastólico positivo deben hacer pensar en una artropatía de Charcot activa(13) o en una neuropatía periférica del sistema nervioso autónomo, que provoca la apertura de fístulas arteriovenosas(10).
figura-1.jpg
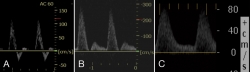
Figura 1. Diferentes tipos de curva Doppler. A: curva trifásica considerada como normal; B: curva bifásica que indica patología proximal; C: curva monofásica que además presenta flujo durante toda la diástole, lo que indica baja resistencia periférica provocada por la presencia de fístulas arteriovenosas en la microcirculación.
El Doppler continuo puede a su vez usarse para la determinación del índice tobillo-brazo. Este índice se considera normal si es superior o igual a 0,9. Por debajo de 0,9 indica enfermedad arterial periférica y por debajo de 0,8 aumenta el riesgo de isquemia de la extremidad, si bien se considera que los pacientes con índice tobillo-brazo superior o igual a 0,6 deben ser manejados de forma conservadora durante al menos 6 semanas(2), durante las cuales se considera que deben usarse las medidas habituales de desbridamiento de las heridas y curas adecuadas con descargas del pie. Hay que tener en cuenta que el valor del índice en estos niveles entre 0,6 y 0,8 puede estar falsamente elevado debido a la presencia de calcificaciones arteriales que lo eleven de forma patológica. Por esa razón, es de vital importancia en caso de que estos pacientes no evolucionen favorablemente valorar una nueva prueba de imagen o decidir un tratamiento de revascularización si se considera oportuno.
Si el valor del índice tobillo-brazo es superior a 1,3, el paciente padece una calcificación severa del árbol arterial con arterias no compresibles. En este caso, no se puede valorar correctamente la irrigación del pie y se hace necesaria la valoración por parte de un cirujano vascular.
Cuando el índice es inferior a 0,6, este indica isquemia significativa de los tejidos que puede dificultar la curación de una úlcera(10). En estos casos y en especial cuando el índice es inferior a 0,5, se recomiendan pruebas de imagen para valorar la arteriopatía y tomar las medidas adecuadas para revascularizar.
Dado que, como hemos visto, la medición del índice tobillo-brazo se ve artefactada por diferentes factores, se han buscado otras mediciones que permitan tener informaciones más fidedignas para tomar decisiones de forma más fiable.
La presión digital no se ve artefactada de forma tan importante por las calcificaciones como las arterias distales de la pierna. Su inconveniente es que es una prueba más inaccesible, ya que se requiere instrumental que pocas veces está disponible a la cabecera del paciente y menos si no estamos en centros altamente especializados. Esto no quita valor a los datos que nos puede aportar. Una presión digital inferior a 30 mmHg indica mayor dificultad para la curación de una herida(10,11,12).
Pero la prueba que más información nos da en relación con la curación de una úlcera es la TcPO2 o presión transcutánea de oxígeno. Esta es una prueba que no está disponible en la mayoría de los centros pese al valor que tiene. Los valores normales se consideran superiores a 60 mmHg. Los valores inferiores a 25 mmHg indican que probablemente las úlceras que pueda tener el paciente no curarán y que se requiere una prueba de imagen(10,11,12) para valorar cirugía arterial.
Si la úlcera no cura en 6 semanas pese a un correcto tratamiento de la misma, hay que valorar la práctica de una prueba de imagen como la eco-Doppler color, la angiotomografía computarizada (angio-TC), la angiorresonancia magnética (angio-RM) o la arteriografía digital. Esta última es el patrón oro; sin embargo, siempre que sea posible y esté accesible, la primera aproximación será una eco-Doppler color, ya que es más económica y menos agresiva para el paciente, a la par que permite en muchas ocasiones una correcta valoración prequirúrgica del paciente.
En aquellos pacientes que deban ser sometidos a cirugía ortopédica y que no tengan ondas trifásicas y pulsos presentes en tibial anterior y posterior, es obligada la valoración conjunta del traumatólogo y del cirujano vascular para determinar el riesgo que representa la cirugía en relación con la posible isquemia del pie y, de forma individual en cada caso, decidir cuál es la actitud más adecuada. No hay que olvidar que la cirugía profiláctica de la isquemia para evitar lesiones en un pie diabético no está indicada(11), si bien la correcta valoración del paciente permitirá disminuir el riesgo que represente la cirugía.
Tratamiento de la arteriopatía en el paciente con pie diabético
Actualmente no hay evidencia de que un tipo de tratamiento de revascularización sea superior a los demás. Tanto el tratamiento endovascular como el pontaje tradicional son técnicas válidas(5,9,14), si bien la cirugía del pontaje obtiene mejores resultados en salvamento de la extremidad a un año y menos reintervenciones. De hecho, se considera que ante lesiones largas y si se dispone de un conducto autólogo apropiado para realizar el pontaje, especialmente si se trata de la vena safena interna ipsilateral, la mejor opción es la quirúrgica tradicional. Actualmente, el BASIL, que es un ensayo clínico en el que se compara el pontaje y las técnicas endovasculares, recomienda el pontaje en aquellos pacientes en los que sea posible realizarlo y tengan una esperanza de vida superior a 2 años(15) antes que las reparaciones endovasculares.
El aumento del número de reintervenciones en aquellos pacientes que son sometidos a cirugía endovascular hace que los costes y riesgos acumulados para este subgrupo aumenten y, por lo tanto, se diluya el beneficio de la técnica que a priori es más seductora en tanto en cuanto es menos agresiva inicialmente para el paciente(5).
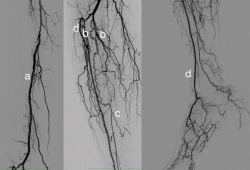
La mayor parte de estos pacientes tienen una afectación arterial multisegmentaria con afectación sobre todo de troncos distales, respetando habitualmente la arteria peronea y con menor frecuencia los vasos distales tanto anteriores como posteriores(16) (Figura 2).
figura-2.jpg
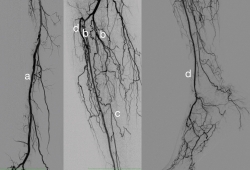
Figura 2. En esta arteriografía se aprecia el patrón habitual de los pacientes con arteriopatía diabética. Se aprecia (a) una arteriopatía proximal con afectación difusa de la femoral superficial y (b) una arteriopatía severa de troncos distales con oclusión de todos ellos en su origen. La arteria peronea (c) se encuentra respetada desde su tercio medio y la tibial anterior (d) se recanaliza gracias a una colateral en el tercio proximal y llega directamente al pie. Esta arteriografía se realizó en una paciente de 89 años que había tenido una úlcera que cicatrizó correctamente con descarga y curas de la herida y que tras 2 meses de estar curada se reabrió y presentó dolor en reposo, por lo que se estudió de nuevo.
En aquellos casos en los que se consigue llevar flujo directo al pie, se aumenta la TcPO2 de forma significativa, con lo cual aumenta también la posibilidad de cura de la úlcera.
En cualquier caso, no se debe intentar siempre una revascularización a cualquier precio; hay que valorar el riesgo-beneficio de la intervención y, si no hay una clara esperanza de obtener mejoría, no realizarla, ya que en ocasiones la manipulación de la arteria empeora la irrigación de la extremidad si el procedimiento fracasa(2,14).
Ante la duda de si revascularizar o no, si el estado del paciente lo permite y las pruebas complementarias no dicen lo contrario, es aceptable un margen de espera de 6 semanas para ver si la herida cura o no. En caso de que no sea así, no se debe demorar la intervención más allá de la octava semana, ya que se ha relacionado la reconstrucción arterial precoz antes de la octava semana de evolución como uno de los factores que mejoran el pronóstico de curación de la herida(4).
Para aquellos pacientes en los que la revascularización no es posible, no todo está perdido. Un 38% de los pacientes no candidatos a revascularizar por su estado general o por dificultades técnicas para la intervención llegan a curar de sus úlceras, si bien un 17% de estos, pese a curar en un primer momento, requerirán una amputación mayor a posteriori. En este subgrupo de pacientes un 33% fallecen sin llegar a curar nunca(17).
Clasificación WIfI
En enero de 2014 la Society for Vascular Surgery publicó una nueva clasificación cuya intención es determinar el riesgo para la extremidad en función de las características de la herida (wound), la isquemia y la infección del pie (foot infection): WIfI(18). Esta clasificación se hace necesaria, ya que tradicionalmente en cirugía vascular se ha usado como definición de una extremidad en riesgo el término isquemia crítica de extremidades inferiores. Este es un término que define una isquemia crónica que pone en riesgo la extremidad. Desde el punto de vista objetivo, se incluirían en este grupo pacientes con presión en tobillo inferior a 40 mmHg y con dolor en reposo, o pacientes con presión en tobillo inferior a 60 mmHg y necrosis tisular(19). El problema es que esta definición no encaja bien en el paciente diabético, entre otras cosas por la limitación de la determinación de presiones en tobillo por las calcificaciones. De hecho, fue creada inicialmente para no incluir pacientes diabéticos.
Los sistemas de clasificación del riesgo publicados hasta la aparición de la clasificación Wifi pecaban de valorar aspectos concretos de la lesión sin abarcar todos los problemas de la herida. En los pocos de ellos en los que se hacía una valoración de la isquemia, esta era tratada como una variable binomial en la que un punto de corte definía la actitud sin tener en cuenta que estos criterios muchas veces se tomaban de los definidos por la isquemia crítica y no se han validado en pacientes diabéticos.
Otro de los puntos débiles de las clasificaciones hasta el momento es que no distinguen habitualmente la úlcera de la gangrena y aquellos que sí lo hacen no distinguen si esta se ha producido por infección o por isquemia.
La clasificación WIfI intenta subsanar estos puntos débiles de las clasificaciones previas para, con una única herramienta, valorar correctamente el riesgo de la extremidad.
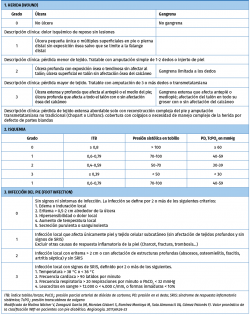
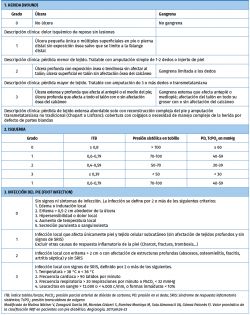
Todos los grados de la clasificación WIfI tienen 4 niveles que van de 0 a 3. En el nivel 0 el aspecto que se está valorando está ausente, es decir, que no hay herida, no hay isquemia o no hay infección. El resto de los niveles se clasifican como leve, moderado o severo.
En relación con la herida, el grado 0 es aquel pie que no tiene heridas abiertas en el momento de realizar la clasificación. El grado 1 sería aquella herida que tiene mínima pérdida tisular y que puede precisar de la amputación de un dedo o bien de injertos cutáneos. La herida de grado 2 sería aquella que precisa de varias amputaciones digitales hasta llegar como máximo a una amputación transmetatarsiana. La herida de grado 3 queda clasificada como toda aquella que precise a priori en el momento del diagnóstico de una amputación mayor que una transmetatarsiana.
La isquemia de grado 0, siguiendo el esquema clásico, sería aquella situación en la que el índice tobillo-brazo es superior o igual a 0,8, con presión en tobillo superior a 100 mmHg o TcPO2 mayor o igual a 60 mmHg. Estos serían los pacientes que tradicionalmente se han considerado como aquellos que curan sin precisar revascularización. Los grados 1 y 2 se corresponderían con los pacientes en los que tradicionalmente tendríamos dudas en relación con las posibilidades de curación debido a su isquemia, y el grado 3 serían aquellos pacientes en los que, hasta la aparición de esta clasificación, no habría duda de que requieren una revascularización para curar la herida. Son aquellos que tienen un índice tobillo-brazo inferior o igual a 0,39 o una presión digital o TcPO2 inferior a 30 mmHg. (Tabla 1).
La infección se clasifica de nuevo en 4 niveles. El 0 no presenta infección. El grado 1 tiene una infección leve, limitada al tejido cutáneo y subcutáneo sin afectación sistémica de ningún tipo. El grado 2 se presenta como una infección local con eritema de más de 2 cm o que afecta a estructuras profundas, o bien se presenta como un absceso. El grado 3 es una infección severa, que además de todo lo anterior provoca un síndrome de respuesta inflamatoria sistémica con, como mínimo, la presencia de 2 de los siguientes:
• Temperatura > 38 o < 36 °C.
• Frecuencia cardiaca > 90 latidos por minuto.
• Frecuencia respiratoria > 20 respiraciones por minuto o PaCO2 < 32 mmHg.
• Leucocitos > 12.000, < 4000 c/mm o bandas > 10%.
En función de los parámetros antes indicados, se evalúa el riesgo de amputación a 1 año y el beneficio de la revascularización, asumiendo que la infección se controle primero.
Con las combinaciones de los parámetros anteriores se determinan 5 estadios en los que se determina el riesgo para la extremidad:
• Estadio 1: riesgo muy bajo.
• Estadio 2: riesgo bajo.
• Estadio 3: riesgo moderado.
• Estadio 4: riesgo alto.
• Estadio 5: extremidad inviable.
Actualmente, esta clasificación está en revisión y hay diferentes artículos que validan la capacidad para predecir el riesgo de amputación de la extremidad(20,21) o la curación de la herida(22).
De modo que parece hoy por hoy que puede ser una herramienta interdisciplinar que nos ayude a determinar qué actitud debemos tener ante un paciente con pie diabético y cómo priorizarlo.
Comentarios
La valoración vascular del pie diabético no es sencilla en tanto en cuanto no solo se ve influida por el estado objetivo de la irrigación del pie, sino también por el grado de lesión e infección que padezca el paciente.
Por otro lado, los criterios básicos para evaluar un pie sin isquemia que ponga en riesgo la extremidad son relativamente sencillos de valorar por cualquier médico mínimamente entrenado. La palpación de pulsos y el índice tobillo-brazo pueden ser herramientas iniciales para poder orientar si un paciente está en riesgo o no.
La isquemia puede verse agravada por procedimientos quirúrgicos que precisen isquemia para minimizar el sangrado. El control de estos pacientes en el postoperatorio es fundamental para detectar problemas antes de que sean imposibles de resolver. Es preciso controlar los pulsos y, aunque parezca obvio, tenerlos registrados previamente a la cirugía. En ocasiones, cuando surge la duda de cómo se encuentra la extremidad de un paciente, no hay nadie del equipo habitual que conozca la situación basal del paciente, especialmente en grandes hospitales. Ante esta situación, saber qué pulsos tenía el paciente antes de la cirugía puede ser de gran ayuda. En este sentido y para el control de estos pacientes, sobre todo si se usan manguitos de isquemia, el uso de pulsioxímetros puede ser una referencia más que nos ayude a tomar decisiones en el postoperatorio.
Es importante que el paciente que no evoluciona correctamente sea valorado por un cirujano vascular y se practiquen pruebas complementarias que permitan evaluar las opciones de revascularización.
Pese a todo lo anterior, no siempre es posible revascularizar la extremidad y, en función del riesgo-beneficio, de deben adoptar en ocasiones actitudes conservadoras.
Hay que tener en cuenta que una curación previa de una úlcera no presupone una curación futura, ya que un 37% de los pacientes con isquemia severa pueden llegar a curar sin revascularizar. Estos pacientes son especialmente susceptibles a una reapertura de la herida, por lo tanto, ante una úlcera reabierta sería bueno consultar con un cirujano vascular.
Figuras
Figura 1. Diferentes tipos de curva Doppler. A: curva trifásica considerada como normal; B: curva bifásica que indica patología proximal; C: curva monofásica que además presenta flujo durante toda la diástole, lo que indica baja resistencia periférica provocada por la presencia de fístulas arteriovenosas en la microcirculación.
Figura 2. En esta arteriografía se aprecia el patrón habitual de los pacientes con arteriopatía diabética. Se aprecia (a) una arteriopatía proximal con afectación difusa de la femoral superficial y (b) una arteriopatía severa de troncos distales con oclusión de todos ellos en su origen. La arteria peronea (c) se encuentra respetada desde su tercio medio y la tibial anterior (d) se recanaliza gracias a una colateral en el tercio proximal y llega directamente al pie. Esta arteriografía se realizó en una paciente de 89 años que había tenido una úlcera que cicatrizó correctamente con descarga y curas de la herida y que tras 2 meses de estar curada se reabrió y presentó dolor en reposo, por lo que se estudió de nuevo.
Tablas
Cita bibliográfica
Autores
Nicolás Allegue Allegue
Unidad de Pie Diabético. Servicio de Angiología y Cirugía Vascular. Hospital Universitario Vall d’Hebron. Barcelona
Anna Gené Mola
Unidad de Pie Diabético. Servicio de Angiología y Cirugía Vascular. Hospital Universitario Vall d’Hebron. Barcelona
Referencias bibliográficas
-
1International Diabetes Federation. IDF Diabetes Atlas. Brussels: International Diabetes Federation; 2017.
-
2Brownrigg JRW, Apelqvist J, Bakker K, Schaper NC, Hinchliffe RJ. Evidence-based Management of PAD & the Diabetic Foot. Eur J Vasc Endovasc Surg. 2013;45(6):673-81.
-
3Prompers L, Huijberts M, Apelqvist J, Jude E, Piaggesi A, Bakker K, et al. Delivery of care to diabetic patients with foot ulcers in daily practice: results of the Eurodiale Study, a prospective cohort study. Diabet Med. 2008;25(6):700-7.
-
4Elgzyri T, Larsson J, Nyberg P, Thörne J, Eriksson KF, Apelqvist J. Early Revascularization after Admittance to a Diabetic Foot Center Affects the Healing Probability of Ischemic Foot Ulcer in Patients with Diabetes. Eur J Vasc Endovasc Surg. 2014;48(4):440-6.
-
5Skrepnek GH, Armstrong DG, Mills JL. Open bypass and endovascular procedures among diabetic foot ulcer cases in the United States from 2001 to 2010. J Vasc Surg. 2014;60(5):1255-65.
-
6Prompers L, Huijberts M, Schaper N, Apelqvist J, Bakker K, Edmonds M, et al. Resource utilisation and costs associated with the treatment of diabetic foot ulcers. Prospective data from the Eurodiale Study. Diabetologia. 2008;51(10):1826-34.
-
7Rogers LC, Andros G, Caporusso J, Harkless LB, Mills JL, Armstrong DG. Toe and flow: essential components and structure of the amputation prevention team. J Am Podiatr Med Assoc. 2010;100(5):342-8.
-
8Faglia E, Clerici G, Scatena A, Caminiti M, Curci V, Prisco M, et al. Severity of demographic and clinical characteristics, revascularization feasibility, major amputation, and mortality rate in diabetic patients admitted to a tertiary diabetic foot center for critical limb ischemia: comparison of 2 cohorts recruited at a 10-year distance. Ann Vasc Surg. 2014;28(7):1729-36.
-
9Hinchliffe RJ, Brownrigg JRW, Apelqvist J, Boyko EJ, Fitridge R, Mills JL, et al. IWGDF guidance on the diagnosis, prognosis and management of peripheral artery disease in patients with foot ulcers in diabetes: IWGDF Guidance on Peripheral Artery Disease. Diabetes Metab Res Rev. 2016;32:37-44.
-
10Ricco JB, Thanh Phong L, Schneider F, Illuminati G, Belmonte R, Valagier A, et al. The diabetic foot: a review. J Cardiovasc Surg (Torino). 2013;54(6):755-62.
-
11Hingorani A, LaMuraglia GM, Henke P, Meissner MH, Loretz L, Zinszer KM, et al. The management of diabetic foot: a clinical practice guideline by the Society for Vascular Surgery in collaboration with the American Podiatric Medical Association and the Society for Vascular Medicine. J Vasc Surg. 2016;63(2 Suppl):3S-21S.
-
12Andersen CA. Noninvasive assessment of lower extremity hemodynamics in individuals with diabetes mellitus. J Vasc Surg. 2010;52(3 Suppl):76S-80S.
-
13Wu T, Chen PY, Chen CH, Wang CL. Doppler spectrum analysis: a potentially useful diagnostic tool for planning the treatment of patients with Charcot arthropathy of the foot? Bone Jt J. 2012;94-B(3):344-7.
-
14Hinchliffe RJ, Andros G, Apelqvist J, Bakker K, Fiedrichs S, Lammer J, et al. A systematic review of the effectiveness of revascularization of the ulcerated foot in patients with diabetes and peripheral arterial disease: Effectiveness of Revascularization of the Ulcerated Foot. Diabetes Metab Res Rev. 2012;28:179-217.
-
15Bradbury AW. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial in perspective. J Vasc Surg. 2010;51(5 Suppl):1S-4S.
-
16Graziani L, Silvestro A, Bertone V, Manara E, Andreini R, Sigala A, et al. Vascular Involvement in Diabetic Subjects with Ischemic Foot Ulcer: a New Morphologic Categorization of Disease Severity. Eur J Vasc Endovasc Surg. 2007;33(4):453-60.
-
17Elgzyri T, Larsson J, Thörne J, Eriksson KF, Apelqvist J. Outcome of Ischemic Foot Ulcer in Diabetic Patients Who Had no Invasive Vascular Intervention. Eur J Vasc Endovasc Surg. 2013;46(1):110-7.
-
18Mills JL, Conte MS, Armstrong DG, Pomposelli FB, Schanzer A, Sidawy AN, et al. The Society for Vascular Surgery Lower Extremity Threatened Limb Classification System: risk stratification based on wound, ischemia, and foot infection (WIfI). J Vasc Surg. 2014;59(1):220-34.e1-2.
-
19Jamieson C. The definition of critical ischaemia of a limb. Br J Surg. 1982;69 Suppl:S1.
-
20Molina Nácher V, Zaragozá García JM, Morales Gisbert S, Ramírez Montoya M, Sala Almonacil VA, Gómez Palonés FJ. Valor pronóstico de la clasificación WIfI en pacientes con pie diabético. Angiologia. 2017;69(1):26-33.
-
21Darling JD, McCallum JC, Soden PA, Meng Y, Wyers MC, Hamdan AD, et al. Predictive ability of the Society for Vascular Surgery Wound, Ischemia, and foot Infection (WIfI) classification system following infrapopliteal endovascular interventions for critical limb ischemia. J Vasc Surg. 2016;64(3):616-22.
-
22Mathioudakis N, Hicks CW, Canner JK, Sherman RL, Hines KF, Lum YW, et al. The Society for Vascular Surgery Wound, Ischemia, and foot Infection (WIfI) classification system predicts wound healing but not major amputation in patients with diabetic foot ulcers treated in a multidisciplinary setting. J Vasc Surg. 2017;65(6):1698-705.e1.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Introducción
- Abordaje multidisciplinar. Organización de una unidad de pie diabético
- Papel del cirujano vascular en el pie diabético
- Abordaje no quirúrgico del pie diabético
- Abordaje quirúrgico del pie diabético
- Cirugía mínimamente invasiva en el pie diabético
- Utilización del fijador externo en el pie diabético
- Infecciones en el pie diabético
- Abordaje de las fracturas de tobillo en el paciente diabético
- Amputaciones de la extremidad inferior en el paciente diabético
Más en PUBMED
Más en Google Scholar


La Monografía de Actualización de la SEMCPT está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.