Protocolos de actuación en infecciones sobre osteosíntesis en cirugía de pie y tobillo
Acting protocols in osteosynthesis infections in foot and ankle surgery
Resumen:
La infección tras la osteosíntesis de tobillo es un problema relativamente frecuente con el que tratamos en nuestra práctica diaria. Pretendemos en esta actualización describir una serie de algoritmos de decisión terapéutica para cada una de las situaciones, en aras de conseguir los resultados deseados: un tobillo funcional, erradicar la infección y que la fractura consolide. Para esto debemos contar con un equipo multidisciplinar que incluya no solo a traumatólogos sino también a cirujanos plásticos, infectólogos, microbiólogos y radiólogos.
Abstract:
Infection after ankle osteosynthesis is a relatively frequent problem with which we treat in our daily practice. We intend in this update to describe a series of algorithms of therapeutic decision for each one of the situations in order to achieve the desired results: a functional ankle, eradicate the infection and that the fracture healing. For these purposes, we must have a multidisciplinary team that includes not only orthopedic surgeons but also plastic surgeons, infectologists, microbiologists and radiologists.
Introducción
La cirugía de pie y tobillo avanza rápidamente, tanto en la parte ortopédica como en la traumatológica; los cirujanos cada vez somos más agresivos en nuestros tratamientos para realizar mejores reducciones con el fin de alcanzar un mejor resultado funcional. Pero no hay que olvidar que la cirugía sobre el pie y el tobillo tiene unas características especiales que la hace más susceptible a las infecciones, como son: una piel fina, una cobertura muscular escasa y en muchas ocasiones un mal aporte sanguíneo, que empeora en circunstancias cada vez más frecuentes (traumatismos, diabetes, tabaco, alteraciones vasculares)(1). Asimismo, el envejecimiento de la población hace que la comorbilidad asociada de estos pacientes aumente el riesgo de complicaciones.
La patología quirúrgica en el pie y tobillo ha aumentado en los últimos años de forma importante(2). El aumento de la demanda y exigencia de la población ha impulsado la creación de unidades específicas de pie y tobillo en nuestro medio, lo que ha conllevado un aumento del tratamiento quirúrgico de patología tanto degenerativa como traumatológica. Las fracturas de tobillo constituyen un 10% del total de las fracturas(3), siendo la tercera en frecuencia en ancianos, tras la cadera y la muñeca, y la primera en jóvenes(4). La infección en fracturas de tobillo y pilón tibial alcanza una tasa del 10%, aumentando considerablemente en las fracturas de alta energía(5).
Si bien con los parámetros clínicos y de pruebas complementarias (radiología, microbiología, marcadores bioquímicos y hematológicos) tendremos una sospecha suficientemente fundada para poder iniciar un tratamiento reglado, revisando la literatura reciente no encontramos ninguna definición ni criterios exactos para el diagnóstico de certeza de una infección en un paciente con una osteosíntesis en pie y tobillo. Además, la mayoría de los protocolos de tratamiento que existen publicados son derivados de protocolos y algoritmos de infecciones protésicas (principalmente de rodilla y cadera).
Respecto a las infecciones de artroplastias y las de osteosíntesis en pie y tobillo, existen diferencias considerables, debido al origen traumático de nuestros pacientes, presentando un daño asociado en las partes blandas, secundario a la afectación de la microvascularización por el traumatismo, siendo las fracturas alrededor de la tibia distal las de mayor riesgo de infección(6,7).
En los casos de las fracturas abiertas existirá una contaminación propia de la exposición ósea al medio externo, siendo en ocasiones inviable su cierre directo. Estos pacientes, muchas veces politraumatizados, son subsidiarios de múltiples cirugías reconstructivas, tanto en la zona que nos incumbe como en otras áreas de la anatomía, repercutiendo todo ello en el estado local y sistémico del paciente. Otra diferencia respecto a las infecciones de artroplastias radica en la imposibilidad la mayoría de las veces de tomar cultivos mediante artrocentesis, ya que las infecciones ni siempre son articulares, ni en los casos en que sí lo son es posible la toma de las cantidades necesarias para la realización de un cultivo(8).
Objetivo
Nuestro objetivo principal va a ser la consolidación de la fractura, seguido de la erradicación de la infección o, en ciertos casos, la supresión de la infección hasta que la fractura consolide. Habrá, también, que conseguir una cicatrización de la envoltura de los tejidos blandos adyacentes, así como prevenir la aparición de una osteomielitis crónica, todo ello con el fin de restaurar la funcionalidad del pie y tobillo.
Diagnóstico
El diagnóstico de una infección se basa en la combinación de sospecha clínica, exploración del paciente, pruebas de laboratorio (proteína C reactiva –PCR–, velocidad de sedimentación globular –VSG–, hemograma), pruebas de imagen (radiografía, tomografía computarizada –TC–, resonancia magnética –RM–), estudio microbiológico y estudio anatomopatológico(9). Para un correcto rendimiento de estas dos últimas pruebas, es aconsejable la toma de muestras intraquirúrgicas, realizada principalmente en los desbridamientos, ya que las tomas con hisopos tienen una alta tasa de contaminación y falsos positivos(5,6). La sensibilidad y especificidad de los parámetros analíticos es limitada y está en relación con las infecciones más graves: las que tienen cultivos positivos y las que están causadas por microorganismos de mayor virulencia como el S. aureus(10).
Estrategia de actuación
Para facilitar la estrategia, debemos realizarnos una serie de preguntas clave para tener la información necesaria para poder aplicar nuestros algoritmos de una manera eficiente(7) (Tabla 1).
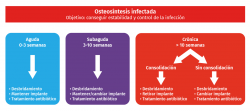
Empezaremos preguntándonos por el tiempo de aparición de los síntomas para clasificar nuestra infección en aguda (menos de 3 semanas), subaguda (entre 3 y 10 semanas) y crónica (más de 10 semanas o una evolución indefinida). El tiempo de evolución nos indicará la maduración del biofilm, ya que se considera maduro a partir de la tercera semana(7).
Seguiremos por el estado de la consolidación de la fractura o, por lo menos, si existe la evidencia de un callo estable. Nos preguntaremos por la estabilidad de la síntesis y si la reducción de la fractura es correcta, pues, en caso de no serlo, además de tratar la infección tendremos que mejorar la reducción de la fractura. Resulta importante evaluar el tipo de implante (placas, tornillos, clavos endomedulares…), ya que cada uno de ellos conllevará un tipo diferente de planteamiento de la cirugía de rescate. Muchas veces el tipo de implante es característico de la localización de la fractura, así como del estado de las partes blandas, como por ejemplo una fractura de pilón tibial, que conlleva en la mayoría de los casos una osteosíntesis con placas y un sufrimiento asociado de las partes blandas.
No debemos olvidarnos nunca de la idiosincrasia del paciente y de su estado basal: edad, enfermedades metabólicas, vasculares, medicación concomitante… o antecedentes previos de infección o herida en las partes blandas adyacentes, siendo un claro ejemplo la fractura de tobillo en pacientes con insuficiencia vascular y úlceras pretibiales crónicas secundarias a insuficiencia vascular(6). Entre los factores de riesgo de infección tras osteosíntesis de tobillo se incluyen: diabetes, enfermedad vascular, edad > 65 años, abuso de alcohol, obesidad, ASA > 3, fracturas de alta energía o fracturas luxaciones(4,11).
Nuestra última pregunta será el tipo de patógeno implicado, ya que, en función de su naturaleza, los antibióticos serán más o menos efectivos (resistencias antibióticas, biofilm…). El agente patógeno más prevalente en pie y tobillo según describen Cook et al.(12) es principalmente el S. aureus con un 30%, seguido de una afectación polimicrobiana con el 27% y los estafilococos coagulasa negativos con un 22% de prevalencia(6).
Cada centro suele tener unos patógenos predominantes con unas resistencias específicas que inevitablemente van aumentando.
Una vez nos hemos contestado estas preguntas, pasaremos al tratamiento aplicando los algoritmos propuestos.
Tratamiento
Basándonos en el artículo publicado por Metsemakers en 2016(8), hemos realizado un algoritmo general de tratamiento presentado en el Congreso Nacional SEMCPT de Sevilla de 2018.
Se debe determinar el tiempo de infección, pudiendo definir la infección como aguda (menos de 3 semanas desde la aparición de los síntomas), subaguda (entre 3 y 10 semanas) y crónica (más de 10 semanas o evolución indefinida). Cuanto mayor es el tiempo transcurrido hasta el diagnóstico, peor pronóstico y más agresivos tendremos que ser, ya que aumenta la afectación de los tejidos blandos, huesos y maduración del biofilm(6). La formación del biofilm se puede resumir en 3 etapas:
1) fijación de las bacterias a la superficie; 2) secreción de sustancia polisacárida extracelular; y 3) maduración completa del biofilm(13,14).
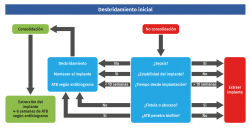
Como podemos observar en el algoritmo general de tratamiento (Figura 1), el tratamiento de cualquier osteosíntesis infectada debe incluir un desbridamiento inicial y un tratamiento antibiótico posterior en función del germen causante.
Por ello, el primer paso, de suma importancia, es el desbridamiento inicial, ya que nos va a permitir identificar el organismo patógeno, escindir el tejido no viable, abscesos y posibles fístulas, estabilizar los fragmentos óseos y determinar la necesidad de tratamientos de las partes blandas y espacios muertos(5,12). Dicho desbridamiento debe ser precoz y extenso, con toma de 4 muestras para cultivos y una para anatomía patológica(9). En caso de retirar material de osteosíntesis, se recomienda realizar un estudio microbiológico con sonicación del material, ya que permite romper el biofilm y detectar mayor número de patógenos, sobre todo de baja virulencia como el Corynebacterium, Propionibacterium spp., etc. Dichos patógenos serán considerados como tales si están aislados por lo menos en dos muestras diferentes(15).
Durante el desbridamiento inicial nos podemos encontrar varias situaciones(5,7,16):
- Podría ser que la fractura se encuentre correctamente consolidada; en esta situación, nuestra actitud a seguir sería la extracción del material de osteosíntesis (EMO) y antibioterapia (ATB).
- Si no lo está, tendremos que elegir entre desbridar y mantener la síntesis o desbridar y retirarla. Si la infección es temprana (sin tiempo para formación y maduración del biofilm), lo ideal es realizar el desbridamiento y mantener el implante, siempre que la reducción sea correcta, para intentar conseguir la consolidación de la fractura. Si la fractura no estuviera correctamente reducida, deberemos realizar una nueva reducción y osteosíntesis, quizás empleando sistemas de liberación de antibióticos locales (hidrogeles con antibiótico, rosario de gentamicina…)(17).
- Si la infección es subaguda o crónica, debemos plantearnos el mantener, extraer o cambiar el implante. Para esta decisión deberemos valorar la gravedad de la situación: estado sistémico del paciente, estabilidad de la fractura, duración de los síntomas, correcta implantación de la síntesis, existencia de fístula, biofilm.
En términos generales, podríamos afirmar que, a mayor gravedad de la situación, mayor agresividad de nuestro planteamiento terapéutico (Figura 2). Se debería mantener el implante siempre que el germen aislado sea sensible a antibióticos que sean capaces de atravesar el biofilm.
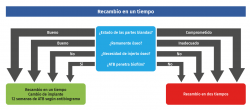
En caso de precisar la extracción de los implantes, tenemos varias opciones; la ideal sería el recambio en un tiempo, ya que permite eliminar los patógenos adheridos al material de síntesis previo, realizar un amplio desbridamiento y continuar con una síntesis estable y definitiva. Dicha situación es factible cuando el estado de las partes blandas y óseas es bueno.
Las contraindicaciones absolutas del recambio en un tiempo son: lesión del paquete neurovascular y fístula activa. Se debería retirar el implante siempre que el germen aislado no sea sensible a antibióticos que sean capaces de atravesar el biofilm (Figura 3).
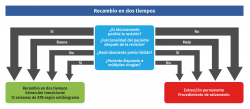
Cuando no se dan las condiciones para un recambio en un tiempo, deberemos realizar una EMO y estabilización temporal (fijación externa en la mayoría de los casos) (Figura 4). El recambio en dos tiempos es el método preferido para el tratamiento de las infecciones crónicas, especialmente en prótesis inestables o aflojadas, pudiéndose extrapolar a afectaciones articulares en pie y tobillo, con tasas de éxito publicadas que alcanzan el 87%(18). Sin embargo, no hay evidencia clara de que el recambio secuencial sea superior al recambio en un tiempo(19), pero esta bibliografía hace siempre referencia a infecciones protésicas de grandes articulaciones. En nuestro caso, la osteosíntesis en dos tiempos se plantearía si existe la posibilidad de conseguir erradicar la infección en el intervalo y en un segundo tiempo realizar una cirugía reconstructiva que permita obtener la consolidación ósea. Realizaríamos entonces una extracción transicional del implante, intentando mantener una estabilidad ósea (generalmente con fijador externo), espaciador de cemento con intención temporal o mediante un implante que pudiese mantener la función de la articulación comprometida (prótesis de silastic en articulación metatarsofalángica –MTTF–)(12). Durante este tiempo se pauta tratamiento antibiótico específico, generalmente 4-6 semanas, monitorizando posibles efectos adversos, seguido de un periodo de entre 2 y 8 semanas sin tratamiento antibiótico y con normalización clínica y de los parámetros analíticos (VSG, PCR) previo al segundo tiempo, en el que se deberá realizar nuevo desbridamiento y toma de cultivos(20).
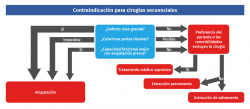
Si esta cirugía en dos tiempos no es posible técnicamente, el paciente no está dispuesto a someterse a múltiples cirugías o ya ha fracasado un recambio previo (Figura 4), se podría plantear una extracción permanente, que consistiría en una extracción definitiva del implante, con resección del hueso y el tejido afectado, pudiendo realizarse en pacientes con baja demanda funcional y en donde la función no es crucial, ya que se encuentra comprometida de forma importante. Para casos seleccionados en este tipo de pacientes existe la posibilidad de un espaciador de cemento como tratamiento definitivo(21).
Otra opción sería realizar un procedimiento de salvamento, en el que no conservamos la función, pero sí se otorga una mayor estabilidad a largo plazo en pacientes activos (artrodesis en dos tiempos). Es posible realizar una artrodesis tibiotalocalcánea con enclavado endomedular retrógrado con antibiótico en pacientes con afectación severa de dichas articulaciones(22).
Finalmente, en pacientes en los que el defecto óseo es muy grande y sin posibilidad de conseguir una correcta cobertura de partes blandas, el patógeno es multirresistente o el resultado funcional final no es aceptable, no debemos descartar la amputación, ya que en estos pacientes una amputación infrarrotuliana puede alcanzar una gran funcionalidad y una calidad de vida aceptable(23) (Figura 5).
Existe un grupo de pacientes en los que la cirugía no es posible, bien por su condición basal o por su negativa a la misma. En dichos pacientes un tratamiento antibiótico supresivo durante un periodo de tiempo muy largo o incluso permanente puede ser una opción(24).
Generalidades del tratamiento con antibióticos
La mejor combinación de antibióticos será para cada caso la que muestre la información obtenida de los cultivos y sus antibiogramas. Después de tomar los cultivos, se puede empezar con una terapia empírica consistente en vancomicina 1 g intravenoso (i.v.) cada 12 horas y ceftazidima 1 g cada 8 horas i.v. durante los 5 primeros días, asociando al quinto día rifampicina 600 mg por vía oral (v.o.) cada 24 horas, hasta la realización del cultivo(7,20). La asociación de rifampicina ha demostrado resultados satisfactorios de hasta el 90% en casos de infección por estafilococos (patógeno más frecuente) y buena penetración del antibiótico en el biofilm(25,26).
La duración mínima del tratamiento antibiótico deber ser de entre 4 y 6 semanas, siendo de 6 cuando se mantiene el implante(16). Existe consenso en el inicio del tratamiento de forma i.v., pero persiste la controversia de la duración de la misma, que va desde 10 días(7) hasta 3 semanas(16). En el seguimiento del paciente debe primar la sintomatología, pudiendo monitorizar la evolución de PCR y VSG, siempre que estuvieran elevadas al inicio del tratamiento(20,27).
Conclusiones
A pesar de todos los algoritmos expuestos, podríamos decir que no existe ningún protocolo único para el tratamiento de las infecciones de osteosíntesis en pie y tobillo. No obstante, los algoritmos propuestos son una guía adecuada para la gran mayoría de las infecciones en el entorno del pie y el tobillo. Hay que remarcar que la estabilidad es un objetivo principal en este tipo de pacientes, pudiendo afirmar que la estabilidad cura la infección; por tanto, siempre hay que buscar la consolidación. Pero, además, independientemente de la acción quirúrgica, precisaremos de un equipo multidisciplinar para el tratamiento global del paciente, que incluirá infectólogos, cirujanos plásticos y vasculares e internistas, junto al cirujano de pie y tobillo, realizando una valoración individualizada de cada paciente y en cada etapa de la evolución.
Tablas
Figuras
Información del artículo
Cita bibliográfica
Autores
Jaime Antonio Sánchez Lázaro
Servicio de Cirugía Ortopédica y Traumatología. Complejo Asistencial Universitario de León.
Hospital San Juan de Dios. León
Universidad de Salamanca
Unidad de Pie y Tobillo. Complejo Asistencial Universitario de León
Francisco José Madera González
Servicio de Cirugía Ortopédica y Traumatología, Complejo Asistencial Universitario de León.
Unidad de Pie y Tobillo. Complejo Asistencial Universitario de León
Óscar Fernández Hernández
Servicio de Cirugía Ortopédica y Traumatología, Complejo Asistencial Universitario de León.
Unidad de Pie y Tobillo. Complejo Asistencial Universitario de León
José Guerra Laso
Unidad de Enfermedades Infecciosas. Complejo Asistencial Universitario de León
Mario Herrera Pérez
Grupo de Investigación en Traumatología y Ortopedia. Universidad de La Laguna. Santa Cruz de Tenerife. Canarias
Hospital Universitario de Canarias. La Laguna. Tenerife
Tesorero de la SEMCPT
Facultad de Ciencias de la Salud. Universidad de La Laguna. Tenerife
Director de la Revista del Pie y Tobillo
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Nuestra Señora de Candelaria. La Laguna. Tenerife
Unidad Acreditada de Pie y Tobillo. HUC. Tenerife
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Malizos K, Gougoulias N, Dailiana Z, Varitimidis S, Bargiotas K, Paridis D. Ankle and foot osteomyelitis: treatment protocol and clinical results. Injury. 2010 Mar;41(3):285-93.
-
2Shibuya N, Davis M, Jupiter D. Epidemiology of foot and ankle fractures in the United States: an analysis of the National Trauma Data Bank (2007-2011). J Foot Ankle Surg. 2014 Sep-Oct;53(5):606-8.
-
3Luque M, Peris D, Martín-Vivaldi A, Ayllón R, Quirante S, Prados N. Complicaciones infecciosas tras la osteosínteis de tobillo. Rev Pie Tobillo. 2018;32(1):3-11.
-
4Kelly EG, Cashman JP, Groarke PJ, Morris SF. Risk factors for surgical site infection following operative ankle fracture fixation. Ir J Med Sci. 2013 Sep;182(3):453-6.
-
5Pérez-Prieto D, Portillo M, González-Lucena G, Ginés-Cespedosa A. Foot and ankle infections: debridement, early fixation and rifampicin provide earlier recovery of function and quality of life. Foot Ankle Surg. 2019 Feb;25(1):13-8.
-
6Fang C, Wong TM, Lau TW, To KK, Wong SS, Leung F. Infection after fracture osteosynthesis - Part I. J Orthop Surg (Hong Kong). 2017 Jan;25(1):2309499017692712.
-
7Hellebrekers P, Leenen LP, Hoekstra M, Hietbrink F. Effect of standardized treatment regime for infection after osteosynthesis. J Orthop Surg Res. 2017 Mar 9;12(1):41.
-
8Metsemakers WJ, Kuehl R, Moriarty TF, Richards RG, Verhofstad MHJ, Borens O, et al. Infection after fracture fixation: current surgical and microbiological concepts. Injury. 2018 Mar;49(3):511-22.
-
9Zmistowski B, Della Valle C, Bauer TW, Malizos KN, Alavi A, Bedair H, et al. Diagnosis of periprosthetic joint infection. J Arthroplasty. 2014 Feb;29(2 Suppl):77-83.
-
10Kheir MM, Tan TL, Shohat N, Foltz C, Parvizi J. Routine Diagnostic Tests for Periprosthetic Joint Infection Demonstrate a High False-Negative Rate and Are Influenced by the Infecting Organism. J Bone Joint Surg Am. 2018 Dec 5;100(23):2057-65.
-
11Shao J, Zhang H, Yin B, Li J, Zhu Y, Zhang Y. Risk factors for surgical site infection following operative treatment of ankle fractures: a systematic review and meta-analysis. Int J Surg. 2018 Aug;56:124-32.
-
12Cook JJ, Sganga M. Infected Nonunions and Infected Hardware. En: Boffeli TJ (ed.). Osteomyelitis of the Foot and Ankle. Medical and Surgical Management. Springer; 2015. pp. 75-89.
-
13Kumar A, Alam A, Rani M, Ehtesham NZ, Hasnain SE. Biofilms: survival and defense strategy for pathogens. Int J Med Microbiol. 2017 Dec;307(8):481-9.
-
14Roy R, Tiwari M, Donelli G, Tiwari V. Strategies for combating bacterial biofilms: a focus on anti-biofilm agents and their mechanisms of action. Virulence. 2018 Jan 1;9(1):522-54.
-
15Yano MH, Klautau GB, da Silva CB, Nigro S, Avanzi O, Mercadante MT, Salles MJ. Improved diagnosis of infection associated with osteosynthesis by use of sonication of fracture fixation implants. J Clin Microbiol. 2014 Dec;52(12):4176-82.
-
16Fang C, Wong TM, Lau TW, To KK, Wong SS, Leung F. Infection after fracture osteosynthesis - Part II Treatment. J Orthop Surg (Hong Kong). 2017 Jan;25(1).
-
17Malizos K, Blauth M, Danita A, Capuano N, Mezzoprete R, Logoluso N, et al. Fast-resorbable antibiotic-loaded coating to reduce post-surgical infection after internal osteosynthesis: a multicenter randomized controlled trial. J Orthop Traumatol. 2017 Jun;18(2):159-69.
-
18Osmon DR, Berbari EF, Berendt AR, Lew D, Zimmerli W, Steckelberg JM, et al.; Infectious Diseases Society of America. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2013 Jan;56(1):e1-e25.
-
19Gehrke T, Zahar A, Kendoff D. One-stage exchange: it all began here. Bone Joint J. 2013 Nov;95-B(11 Suppl A):77-83.
-
20Ariza J, Cobo J, Baraia-Etxaburu J, Benito N, Bori G, Cabo J, et al.; Spanish Network for the Study of Infectious Diseases and the Sociedad Española de Enfermedades Infecciosas; Microbiología Clínica (SEIMC). Executive summary of management of prosthetic joint infections. Clinical practice guidelines by the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC). Enferm Infecc Microbiol Clin. 2017 Mar;35(3):189-95.
-
21Lee HS, Ahn JY, Lee JS, Lee JY, Jeong JJ, Choi YR. Cement arthroplasty for ankle joint destruction. J Bone Joint Surg Am. 2014 Sep 3;96(17):1468-75.
-
22Herrera-Pérez M, Boluda-Mengod J, Gutiérrez-Morales MJ, País-Brito JL. Tibiotalocalcaneal fusion with a cemented coated retrograde nail as a salvage procedure for infected ORIF of the ankle. Rev Esp Cir Ortop Traumatol. 2017 Nov-Dec; 61(6):441-5.
-
23Boutoille D, Féraille A, Maulaz D, Krempf M. Quality of Life with Diabetes-associated Foot Complications: Comparison Between Lower-limb Amputation and Chronic Foot Ulceration. Foot Ankle Int. 2008 Nov;29(11):1074-8.
-
24Osmon DR, Berbari EF, Berendt AR, Lew D, Zimmerli W, Steckelberg JM, et al.; Infectious Diseases Society of America. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2013 Jan;56(1):e1-e25.
-
25Tschudin-Sutter S, Frei R, Dangel M, Jakob M, Balmelli C, Schaefer DJ, et al. Validation of a treatment algorithm for orthopaedic implant-related infections with device-retention-results from a prospective observational cohort study. Clin Microbiol Infect. 2016 May;22(5):457.e1-9.
-
26Thabit AK, Fatani DF, Bamakhrama MS, Barnawi OA, Basudan LO, Alhejaili SF. Antibiotic penetration into bone and joints: an updated review. Int J Infect Dis. 2019 Feb 14;81:128-36.
-
27Michail M, Jude E, Liaskos C, Karamagiolis S, Makrilakis K, Dimitroulis D, et al. The Performance of Serum Inflammatory Markers for the Diagnosis and Follow-up of Patients With Osteomyelitis. Int J Low Ext Wounds. 2013 May 16;12(2):94-9.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Seguimos avanzando
- Protocolos de actuación en infecciones sobre osteosíntesis en cirugía de pie y tobillo
- Tratamiento de la rotura del complejo lateral externo del tobillo mediante artroscopia anterior y Broström- Gould abierto en pacientes deportistas de alto nivel
- Fascitis plantar recalcitrante: ¿fasciotomía parcial o liberación de gemelo medial? Resultados preliminares a 6 meses
- Transferencia endoscópica del flexor <em>hallucis longus</em> en el tratamiento de las roturas inveteradas del tendón calcáneo
- Artrodesis con espaciadores de tantalio en fracaso de prótesis de tobillo
- Resultados de la cirugía de liberación proximal de gemelo medial en el tratamiento de la tendinopatía insercional de Aquiles
- Tratamiento conservador de la enfermedad de Müller-Weiss. A propósito de un caso
- Método de aumentación en reparación de inestabilidad lateral crónica de tobillo: consejo técnico
- Comentario a “Método de aumentación en reparación de inestabilidad lateral crónica de tobillo: consejo técnico”
- Revista de revistas
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista del pie y tobillo está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.