Protocolo de artroplastia de tobillo de la SEMCPT
SEMCPT ankle arthroplasty protocol
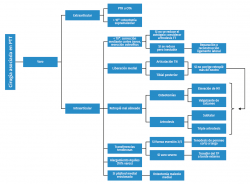
Introducción a la artroplastia de tobillo. Indicaciones
La articulación del tobillo está sometida a más fuerza por unidad de superficie y se lesiona con más frecuencia que cualquier otra articulación del organismo; sin embargo, la prevalencia de artrosis sintomática de tobillo es aproximadamente 9 veces menos frecuente que en la rodilla y la cadera(1). Existe, además, una diferencia epidemiológica importante con la coxartrosis o gonartrosis, ya que la mayoría (65-80%) de las artrosis de tobillo son postraumáticas(2), con afectación predominante de la población más joven.
Durante muchos años, la artrodesis tibiotalar ha sido considerada el tratamiento quirúrgico de elección en la artrosis de tobillo. Además, con la aparición de técnicas artroscópicas, con un mejor manejo de las partes blandas, y de nuevas opciones de fijación, se están obteniendo resultados prometedores con menores complicaciones, mayores tasas de fusión y mejoría en el alivio del dolor(3,4,5). Sin embargo, con el paso del tiempo se ha visto que la artrodesis tan ampliamente utilizada no está exenta de inconvenientes(6), iniciándose la búsqueda de otras alternativas de tratamiento(7,8,9).
Es de sobra conocido que la anulación de la movilidad tibiotalar, cuando se consigue una artrodesis sólida, acelera la degeneración de las articulaciones adyacentes(10). De hecho, se ha publicado que, a los 8 años tras la artrodesis, el 50% de los pacientes tiene artrosis subtalar con repercusión clínica(11) y prácticamente el 100% a los 22 años de seguimiento(12).
Con los implantes de primera generación, en los años setenta del siglo pasado, se obtuvieron complicaciones inaceptables(13), pero los implantes actuales, de tercera generación, que prácticamente imitan la anatomía y la biomecánica del tobillo, han cambiado la historia(14). De hecho, para numerosos autores(15,16,17,18,19), los diseños de las generaciones protésicas actuales y la precisión de las técnicas quirúrgicas tienen el potencial de ofrecer resultados a largo plazo, al menos, similares a los de la artrodesis, con los beneficios que incluyen la conservación de la movilidad del tobillo(20), la mejoría de la marcha(21) y la conservación de las articulaciones adyacentes. Aunque se han publicado tasas de supervivencia del implante del 75-90% a los 10 años(22,23) aún no se conoce la supervivencia a más largo plazo.
Con todo lo descrito hasta ahora, aún hoy en día la artrodesis de tobillo continúa siendo el tratamiento más aceptado para la artrosis de tobillo, con un grado de recomendación A(24).
Indicaciones
Algunos autores(25) definen al paciente ideal: mayor de 50 años, con buena calidad ósea, adecuada alineación, buena estabilidad y movilidad del tobillo conservada, especialmente si además tienen afectación de articulaciones vecinas o afectación bilateral(26), pero pacientes como estos hay muy pocos…
Casos especiales
- Paciente joven: los pacientes jóvenes con artrosis postraumática de tobillo obtienen peores resultados y tienen mayor probabilidad de revisión protésica. Esto es debido a que se suele tratar de secuelas postraumáticas de accidentes de tráfico, laborales o deportivos, de alta energía, con gran afectación articular. En numerosas ocasiones asocian una alteración de los ejes de la extremidad, bien por el traumatismo inicial o bien por la existencia de cirugías previas. Además, las expectativas puestas en esta cirugía no siempre coinciden con el resultado obtenido.
Todo esto ha llevado a recomendar, durante muchos años, la artrodesis de tobillo especialmente en este grupo de pacientes. Sin embargo, cada vez más autores(27,28,29) describen resultados similares, en cuanto a complicaciones y tasas de revisión, en pacientes menores y mayores de 50 años, concluyendo que es una alternativa válida a tener en cuenta. - Afectación poliarticular: los pacientes con cambios degenerativos en otras articulaciones, como la subtalar, la mediotarsal, la rodilla, la cadera y el tobillo contralateral parecen beneficiarse más de una artroplastia que de una artrodesis, ya que esta última sobrecarga las articulaciones vecinas y acelera los cambios degenerativos.
Si la artrosis subastragalina es incipiente y la sintomatología dolorosa la refiere principalmente en el tobillo, la prótesis de tobillo puede, al mantener la movilidad del tobillo, disminuir el estrés mecánico sobre la articulación subastragalina y mejorar la sintomatología. Si el paciente desarrollara síntomas más adelante, se podría realizar una artrodesis subastragalina. Si de inicio ya tiene clínica o cambios degenerativos importantes, podemos combinar la prótesis y la artrodesis subastragalina, bien en la misma cirugía o bien separadas 45-60 días (primero la subastragalina). Asimismo, los pacientes que necesitan o ya tienen hecha una triple artrodesis toleran mejor una prótesis de tobillo que una panartrodesis. - Artritis reumatoide: el paciente con artritis reumatoide y afectación poliarticular es un caso de especial indicación de las prótesis de tobillo(30). A favor de su implantación tendríamos la edad, la afectación poliarticular y la poca demanda funcional. En contra, el aumento del riesgo infeccioso, la osteoporosis asociada y la existencia de otras lesiones que contraindican la prótesis, como grandes deformidades (pie plano) o lesiones ligamentosas.
- Artrodesis tibiotalar dolorosa: en casos muy seleccionados, la prótesis de tobillo puede ser el tratamiento elegido para rescatar una artrodesis dolorosa, bien por pseudoartrosis o bien por mala posición de la fijación, pero no hay muchos casos descritos en la literatura(31,32,33).
Contraindicaciones
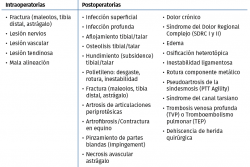
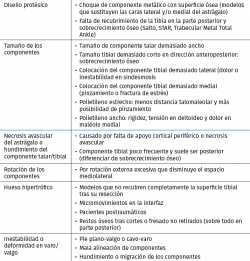
En la Tabla 1 se exponen las contraindicaciones absolutas y en la Tabla 2 las relativas para la implantación de una prótesis total de tobillo (PTT).
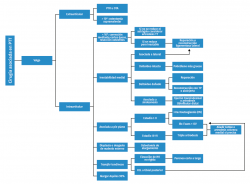
Planificación preoperatoria
Anamnesis
Debemos averiguar cuál es la causa de su artrosis y el tiempo de evolución de la misma, el tipo de dolor, la severidad del mismo y la necesidad de analgesia. Nos interesa saber qué tratamientos han sido aplicados previamente, especialmente si se trata de procedimientos quirúrgicos. Muy importante es saber cuáles son las expectativas posquirúrgicas del paciente, en cuanto a la función esperada y al alivio del dolor, para lo cual es imprescindible preguntar por el nivel de actividad, tanto física como laboral, preoperatoria. Habrá que reflejar, también, factores de riesgo del paciente, como diabetes, obesidad, tabaquismo, osteoporosis, neuropatía…
Exploración física
La exploración física comienza con el examen de toda la extremidad, tanto en estática como dinámica. Anotaremos la alineación del retropié, la estabilidad del tobillo, la movilidad subastragalina y la del tobillo. Es importante también valorar el estado cutáneo, así como la localización y el estado de las cicatrices previas.
Examen radiológico
figura1.png
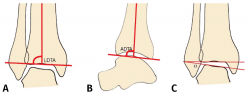
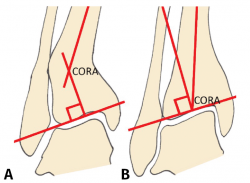
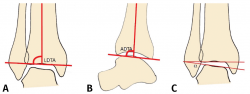
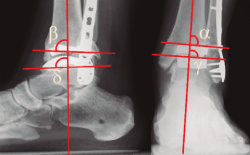
Figura 1. A: ángulo tibial distal lateral (LDTA). Está formado por la superficie tibial articular distal y el eje anatómico de la tibia; B: ángulo tibial distal anterior (ADTA). Está formado por el eje mecánico de la tibia y la línea articular; C: ángulo tibio-talar. Está definido por la orientación de las superficies articulares de la tibia y del astrágalo en el tobillo.
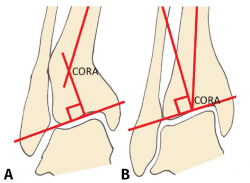
Debe incluir la radiología convencional (siempre en carga) dorsoplantar y lateral de ambos pies, anteroposterior y lateral del tobillo y la proyección de Saltzman. En el caso de haber apreciado deformidades en el miembro, solicitaremos también ambas extremidades completas. En el plano sagital (Figura 1), mediremos el ángulo tibial distal anterior (ADTA, por sus siglas en inglés). Este está formado por el eje mecánico de la tibia y la línea articular, y mide 80 ± 3° en la extremidad normal. Un aumento del ADTA representa una deformidad en recurvatum. En el plano coronal (Figura 1), se valora el ángulo tibial distal lateral (LDTA, por sus siglas en inglés), el ángulo tibio-talar y la alineación calcáneo-tibial. El LDTA(34) está formado por la superficie tibial articular distal y el eje anatómico de la tibia, y mide 89 ± 3°. La alineación calcáneo-tibial (medida en la proyección de Saltzman) es muy útil para confirmar la presencia de deformidades en varo o valgo, así como para valorar la compensación de un LDTA anormal (la articulación subastragalina puede compensar hasta 15° de eversión y 30° de inversión). Si tenemos un ADTA o LDTA anormal (deformidad sagital o coronal), debemos medir el center of rotation of angulation (CORA). Es la intersección entre la línea mediodiafisaria y la línea que comienza en el centro de la articulación y perpendicular al anormal ADTA o LDTA. El CORA puede estar localizado en la línea articular o proximalmente (Figura 2).
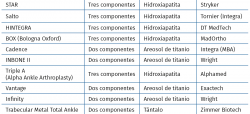
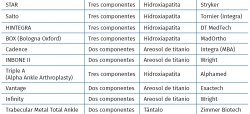
Modelos de prótesis en España
En la Tabla 3 hacemos una relación de los modelos actualmente disponibles en España.
Discusión y conclusiones sobre los modelos de prótesis actuales
Modelos de prótesis
Actualmente, no existen estudios multicéntricos prospectivos aleatorizados (nivel de evidencia I), que permitan recomendar determinados modelos frente a otros.
Polietileno rotatorio frente a fijo
Respecto a las ventajas del inserto de polietileno fijo frente al rotatorio, tampoco existe evidencia científica que nos permita establecer la superioridad de un diseño frente al otro(35,36,37). Los modelos de 3 componentes parecen tener un efecto de desplazamiento posterior del astrágalo (posterior talar shifting) que aparece en un intervalo de 2 a 6 meses tras implantar la PTT. Esto podría constituir una ventaja en aquellas artrosis en las que se produce una subluxación anterior del astrágalo(38,39). Mientras que en los EE. UU. los modelos de 2 componentes son los más utilizados (en parte debido a restricciones de la Food and Drug Administration –FDA–), en Europa son los de 3 componentes los preferidos. Teóricamente, los implantes móviles disminuyen las fuerzas de cizallamiento y rotación al nivel de la interfaz componente-prótesis, pero tienen más riesgo de subluxación, de pinzamiento maleolar o de protrusión. Por otro lado, los insertos fijos no tienen el riesgo de subluxación ni pinzamiento, pero sí serían más susceptibles al aflojamiento debido a la transmisión de micromovimientos a la interfaz hueso-implante. El centrado del componente talar es superior, pero permite menos errores a la hora de su implantación.
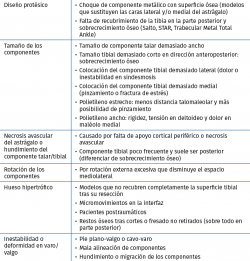
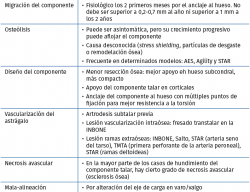
Diseño del componente tibial
Los modelos que no perforan la cortical anterior de la tibia evitarían crear un punto de entrada para las partículas de desgaste que producirían osteólisis y aflojamiento del implante. Por otro lado, aquellos diseños con menor resección ósea y apoyo en hueso subcondral tendrían un mejor apoyo y menor probabilidad de hundimiento, constituyendo una desventaja el uso de vástagos profundos, que transmitirían las cargas a un hueso metafisario más débil. El uso de un vástago cónico único no es capaz de impedir los micromovimientos generados por las fuerzas de rotación al nivel de la interfaz hueso-cemento, constituyendo otra posible causa de fracaso. Los modelos con un platillo tibial anatómico podrían evitar el pinzamiento al nivel del peroné y del tendón del tibial posterior. Es posible que las prótesis con un componente tibial de pequeñas dimensiones, que no cubre completamente el plafond tibial, pudiese asociarse a una mayor probabilidad de calcificaciones heterotópicas, que podrían reducirse en aquellos diseños con solapas anteriores y/o posteriores.
Diseño del componente astragalino
Se recomiendan implantes con una mínima resección de hueso para lograr un apoyo en la zona subcondral. Aquellos implantes que respetan las carillas medial y lateral ofrecen un punto extra de apoyo en las corticales del astrágalo, pudiendo ser una ventaja frente a modelos que las sacrifican.
Tras los fracasos de las prótesis de primera generación, se estableció la importancia de restablecer de forma anatómica los ejes de giro del astrágalo, traduciéndose esto en un componente con un radio medial mayor que el lateral y una parte anterior más ancha que la posterior.
Abordaje anterior
Es el abordaje más común. Permite una visualización excelente de la mortaja tibioperoneoastragalina. Sin embargo, parece asociarse con un mayor riesgo de complicaciones de dehiscencia de la herida(40), con la probabilidad de una infección subsiguiente.
Abordaje lateral
En caso de producirse una dehiscencia de la herida, no se expone directamente la prótesis. Desde este abordaje, se obtiene una buena visualización de la articulación desde su eje principal de movimiento.
Cirugía asociada
Más del 50% de los pacientes con artrosis de tobillo presentan deformidades anatómicas intra- y extraarticulares. Generalmente, se considera que una deformidad en varo o valgo de más de 10° en el tobillo debe ser corregida antes de implantar una prótesis de tobillo. Sin embargo, existen publicaciones que refieren buenos resultados en deformidades de hasta 30°(41,42). Aproximadamente, del 10 al 40% de los pacientes con artrosis de tobillo presentan deformidades superiores a los 10° en el plano coronal(43).
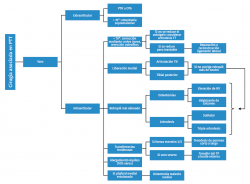
- Deformidad en varo: generalmente los procedimientos asociados pueden realizarse en el mismo procedimiento o espaciarse en el tiempo (Figura 3).
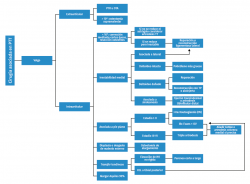
- Deformidad en valgo: las deformidades en valgo pueden ser debidas a un pie planovalgo en estadio IV, postraumáticas o por una inestabilidad medial crónica (Figura 4).
- Deformidades en otros planos y multiplanares:
- Deformidad en recurvatum: desgaste de la parte anterior del plafond tibial por trauma repetitivo del astrágalo con subluxación anterior del astrágalo. Se asocia a contractura de la cápsula posterior y del Aquiles, y acortamiento. Se procede primero resecando los osteofitos, liberando la cápsula posterior y alargando el Aquiles.
- Deformidad en antecurvatum: mucho menos frecuente. Desgaste de la parte posterior del plafond tibial.
Cuidados postoperatorios. Rehabilitación
Una vez finalizado el procedimiento quirúrgico, para mantener el pie y el tobillo en posición neutra, en el quirófano colocamos una férula suropédica. Iniciamos la quimioprofilaxis antibiótica (generalmente cefalosporinas de primera generación) y antitrombótica.
Se mantiene en descarga las primeras 2 semanas postoperatorias, hasta la retirada de los puntos de sutura. Transcurrido ese tiempo y tras la adecuada cicatrización de las partes blandas, se puede comenzar, salvo complicaciones, con la movilidad del tobillo en descarga. Esta fase puede variar, según los procedimientos que se hayan añadido a la cirugía protésica. Se inicia la carga a las 2-4 semanas, de forma progresiva, permitiendo la carga completa a las 6. A las 8-10 semanas comienza la fisioterapia más intensiva: entrenamiento de la marcha, ejercicios de propiocepción, estiramiento y fortalecimiento de tríceps sural.
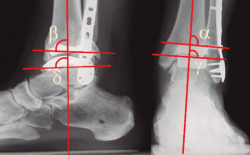
En los controles radiográficos debemos valorar la correcta posición de los componentes protésicos(44) mediante la medición de los ángulos α (tibial coronal), γ (coronal talar), β (sagital tibial) y δ (sagital talar) (Figura 5). Los valores ideales de los ángulos α, γ, y δ son de 90° y de β de 84°, y se aceptan desviaciones de hasta 5°.
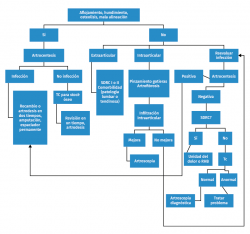
Complicaciones postoperatorias y su manejo. Cirugía de revisión
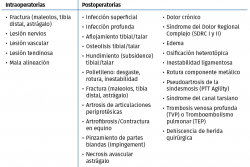
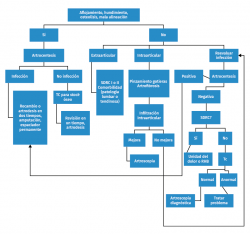
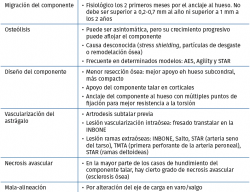
En la Tabla 4 incluimos un resumen de los posibles eventos adversos que pueden ocurrir intraoperatoriamente y postoperatoriamente. Vulcano y Myerson(45) proponen un algoritmo (Figura 6) de diagnóstico y tratamiento de la PTT dolorosa.
Diagnóstico de la prótesis total de tobillo dolorosa
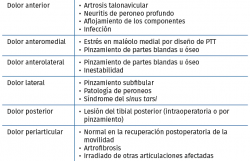
En la Tabla 5 referimos las posibles causas de dolor en una PTT según su localización.
Pruebas diagnósticas
- Infiltraciones: la articulación subtalar puede ser causa de dolor y puede valorarse mediante una infiltración diagnóstico-terapéutica de la misma con anestésico y corticosteroides. Los dolores por pinzamiento en las gotieras también pueden mejorar tras infiltraciones intraarticulares y predicen un buen resultado tras el desbridamiento quirúrgico de las mismas, sobre todo si está localizada en un solo lado.
- Pruebas de imagen: en radiografías en carga, se considera radiolucencia cuando se observa una línea de menos de 2 mm en la interfaz hueso-implante; si supera los 2 mm, se trata de un aflojamiento del componente(46). También se pueden llevar a cabo radiografías en carga del tobillo en flexión y extensión que pueden servir para valorar el rango de movilidad de la articulación tibiotalar de forma aislada. En determinados casos puede ser necesaria la realización de una tomografía computarizada (TC) para valorar el stock óseo, el pinzamiento en las gotieras o el aflojamiento de componentes. En algunos componentes talares que recubren las caras lateral o medial del astrágalo, puede ser difícil valorar un posible aflojamiento. Las imágenes observadas en la TC pueden detectar osteólisis que se ven hasta 3 veces más grandes que en la misma radiografía simple(47).
- Artrocentesis: el líquido sinovial puede ser analizado para determinar el número de leucocitos presentes en la muestra y el porcentaje de polimorfonucleares (PMN). La tinción de Gram no es lo suficientemente sensible o específica para diagnosticar una infección. La prueba del Synovasure® (Zimmer Biomet) tiene una sensibilidad y una especificidad del 97% en la detección de infecciones(45). Un aspirado seco no puede considerarse como excluyente de infección, sobre todo si otras pruebas han resultado positivas.
- Análisis de sangre: también se debe realizar un análisis de sangre que incluya proteína C reactiva (PCR), velocidad de sedimentación globular (VSG) y fórmula leucocitaria.
- Artroscopia: otra posibilidad es la realización de una artroscopia diagnóstica para intentar determinar la causa del dolor e incluso tratarlo en caso de un impingement. También puede usarse para la recogida de muestras o la realización de una biopsia sinovial.
Tratamiento de las principales complicaciones postoperatorias. Cirugía de revisión. Artrodesis secundaria
- Dehiscencia de la herida quirúrgica: hasta en un 15-28%(48,49) de los pacientes pueden existir problemas de retardo de la cicatrización de la herida quirúrgica. Inicialmente, se realizan curas simples, desbridamiento de esfacelos (mediante un bisturí o hidrogeles) y uso de apósitos que creen un ambiente de humedad, protejan la herida y que no maceren los bordes de la herida.
En dehiscencias de mayor tamaño, pueden usarse apósitos con terapia de presión negativa. En casos en los que no sean suficientes las opciones anteriores, se debe valorar la necesidad de un injerto o colgajo cutáneo. - Infección: el porcentaje de infección de una PTT oscila entre el 2 y el 8,5%(49).
Una dehiscencia de la herida o con exudado continuo más de 14 días tras la operación puede estar relacionada con el desarrollo de una infección.
Generalmente, se aplican los conocimientos en el tratamiento de infecciones en prótesis de cadera o rodilla para el tobillo. En el postoperatorio inmediato (menos de 4 semanas), se puede intentar un desbridamiento y lavado con recambio del polietileno, seguido de 6-8 semanas de tratamiento antibiótico intravenoso en función del antibiograma obtenido.
La revisión en 2 tiempos comienza con la retirada del implante y la sustitución por un espaciador de cemento con antibiótico y antibioterapia por vía parenteral durante 6-8 semanas. Posteriormente, una vez normalizados los exámenes analíticos, puede procederse al recambio por una nueva PTT, por la artrodesis o, en caso de mala evolución, por una amputación infracondílea. En algunos casos de baja demanda funcional, el espaciador de cemento puede ser dejado como tratamiento definitivo. - Pinzamiento (impingement): el tratamiento debe adaptarse a cada una de las posibles causas (Tabla 6).
- Artrofibrosis: en caso de rigidez anterior, suele estar limitada la flexión plantar. Debe ser desbridada la parte anterior de la articulación, así como las gotieras medial y lateral. Una vez liberados, debemos comprobar el arco de movimiento. Si la mejoría es insuficiente, debemos proceder a liberar la cápsula posterior.
En los casos en los que predomine una pérdida de dorsiflexión, debemos sospechar una rigidez posterior, ya sea por fibrosis u osificación heterotópica. Si nos decidimos por una cirugía abierta, el abordaje posteromedial es el de elección. Tras la liberación, si resulta insuficiente, procederemos a la liberación anterior y, en último lugar, al alargamiento del tendón de Aquiles. El desbridamiento artroscópico consigue unos resultados limitados de tan solo mejoría parcial del dolor y de la movilidad, con altas tasas de recurrencia que podrían requerir una reintervención mediante una artrotomía adicional(50). - Hundimiento del componente talar: las causas de hundimiento del componente talar quedan referidas en la Tabla 7.
Artrodesis como rescate de la prótesis total de tobillo fallida
La artrodesis en 1 o 2 tiempos está indicada en casos de osteólisis severa, hundimiento o aflojamiento de los componentes e infección. Otra indicación es el fracaso protésico con rigidez y pérdida de movilidad. Preferiblemente se utilizará la misma vía de abordaje que se utilizó para implantar la PTT pero, en caso de que la viabilidad de la piel sea dudosa, se puede optar por un abordaje lateral o posterior. La artrodesis tibiotalocalcánea está recomendada en casos de artrosis subtalar dolorosa o hundimiento talar con grandes pérdidas óseas. Si el defecto es menor de 2 cm, puede optarse por una artrodesis tibiotalar aislada.
En determinados pacientes con baja demanda funcional, la retirada de la PTT y su sustitución por un espaciador definitivo de cemento puede ser la mejor opción(51).
Los resultados de una fusión tras el fracaso de una artroplastia son inferiores a los de una artrodesis primaria(52), con una tasa de pseudoartrosis de entre un 11 y un 42%(53).
Prótesis total de tobillo de revisión
La revisión aislada de los componentes de una PTT puede precisar cirugías asociadas como reconstrucciones ligamentosas, osteotomías periarticulares o transferencias tendinosas.
- El componente tibial puede ser reemplazado por uno nuevo si existe un adecuado soporte medial y lateral con una base de hueso esponjoso superior al 50% de la superficie articular tibial. En caso de que no haya suficiente remanente óseo en los maléolos, esto puede ser solventado mediante el uso de una prótesis que disponga de un vástago intramedular (INBONE® o INVISION®). Estos modelos permiten la introducción de un vástago modular intramedular sin violar la cortical anterior de la tibia, permitiendo una fijación estable a pesar de que existan defectos óseos metafisarios. Para compensar las diferencias de longitud por la pérdida ósea, puede ser utilizado injerto óseo estructural o un inserto de polietileno más grueso (SALTO XT® o INVISION®). Los defectos óseos quísticos deben ser rellenados con injertos.
- El componente talar puede ser revisado mediante un componente del mismo modelo protésico o similar, pero esto suele ocurrir en pocas ocasiones, a causa del escaso hueso remanente debido al menor tamaño del astrágalo y la precariedad de su riego sanguíneo. Existen implantes talares con vástagos largos que permiten un anclaje directo al calcáneo(54). En algunos casos, puede ser necesario implantar un componente a medida o de revisión directamente en el calcáneo(47). Los resultados de las PTT de revisión son inferiores a los de las PTT primarias, con malos resultados en la satisfacción de los pacientes, escalas funcionales con baja puntuación y una pobre supervivencia del implante de solo el 55% a los 10 años(55).
Tablas
Figuras
Figura 1. A: ángulo tibial distal lateral (LDTA). Está formado por la superficie tibial articular distal y el eje anatómico de la tibia; B: ángulo tibial distal anterior (ADTA). Está formado por el eje mecánico de la tibia y la línea articular; C: ángulo tibio-talar. Está definido por la orientación de las superficies articulares de la tibia y del astrágalo en el tobillo.
Figura 2. Medición y determinación del center of rotation of angulation (CORA). A: CORA supramaleolar; B: CORA en la articulación.
Figura 3. Algoritmo de opciones quirúrgicas en el paciente con deformidad en varo. M1: primer metatarsiano; OTA: osteotomía tibial alta; PTR: prótesis total de rodilla; TN: talonavicular; TP: tibial posterior; TT: tibiotalar.
Figura 4. Algoritmo de opciones quirúrgicas en el paciente con deformidad en valgo. M1: primer metatarsiano; OTA: osteotomía tibial alta; PTR: prótesis total de rodilla; TP: tibial posterior; TT: tibiotalar; V: osteotomía varizante.
Figura 5. Control del posicionamiento de los componentes de la prótesis. Ángulos α (tibial coronal), γ (coronal talar), β (sagital tibial) y δ (sagital talar). Explicación en el texto.
Información del artículo
Cita bibliográfica
Autores
Rodrigo Díaz Fernández
Unidad de Pie y Tobillo. Hospital de Manises. Valencia
Unidad de Pie y Tobillo. Vithas Valencia
Universidad Católica de Valencia San Vicente Mártir
Unidad de Pie y Tobillo. Hospital Quirónsalud Valencia
Vocal de Docencia de la SEMCPT
María Sánchez González
Unidad de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitari i Politècnic La Fe. Valencia
Referencias bibliográficas
-
1Huch K. Knee and ankle: human joints with different susceptibility to osteoarthritis reveal different cartilage cellularity and matrix synthesis in vitro. Arch Orthop Trauma Surg. 2001;121(6):301-6.
-
2Horisberger M, Valderrabano V, Hintermann B. Posttraumatic Ankle Osteoarthritis After Ankle-Related Fractures. J Orthop Trauma. 2009;23(1):60-7.
-
3Zwipp H, Rammelt S, Endres T, Heineck J. High union rates and function scores at midterm followup with ankle arthrodesis using a four screw technique. Clin Orthop Relat Res. 2010;468(4):958-68.
-
4Nielsen KK, Linde F, Jensen NC. The outcome of arthroscopic and open surgery ankle arthrodesis. Foot Ankle Surg. 2008;14(3):153-7.
-
5Mückley T, Hofmann G, Bühren V. Tibiotalar Arthrodesis with the Tibial Compression Nail. Eur J Trauma Emerg Surg. 2007;33(2):202-13.
-
6Raikin SM. Arthrodesis of the ankle: arthroscopic, mini-open, and open techniques. Foot Ankle Clin. 2003;8(2):347-59.
-
7Frey C, Halikus NM, Vu-Rose T, Ebramzadeh E. A review of ankle arthrodesis: predisposing factors to nonunion. Foot Ankle Int. 1994;15(11):581-4.
-
8Chalayon O, Wang B, Blankenhorn B, Jackson JB 3rd, Beals T, Nickisch F, Saltzman CL. Factors Affecting the Outcomes of Uncomplicated Primary Open Ankle Arthrodesis. Foot Ankle Int. 2015;36(10):1170-9.
-
9Gordon D, Zicker R, Cullen N, Singh D. Open ankle arthrodeses via an anterior approach. Foot Ankle Int. 2013;34(3):386-91.
-
10Fuchs S, Sandmann C, Skwara A, Chylarecki C. Quality of life 20 years after arthrodesis of the ankle. A study of adjacent joints. J Bone Joint Surg Br. 2003;85(7):994-8.
-
11Muir DC, Amendola A, Saltzman CL. Long-term outcome of ankle arthrodesis. Foot Ankle Clin. 2002;7(4):703-8.
-
12Coester LM, Saltzman CL, Leupold J, Pontarelli W. Long-term results following ankle arthrodesis for post-traumatic arthritis. J Bone Joint Surg Am. 2001;83-A(2):219-28.
-
13Vickerstaff JA, Miles AW, Cunningham JL. A brief history of total ankle replacement and a review of the current status. Med Eng Phys. 2007;29(10):1056-64.
-
14Kakkar R, Siddique M. Stresses in the ankle joint and total ankle replacement design. Foot Ankle Surg. 2011;17:58-63.
-
15Saltzman CL, Mann RA, Ahrens JE, Amendola A, Anderson RB, Berlet GC, et al. Prospective controlled trial of STAR total ankle replacement versus ankle fusion: initial results. Foot Ankle Int. 2009;30(7):579-96.
-
16Pedowitz DI, Kane JM, Smith GM, Saffel HL, Comer C, Raikin SM. Total ankle arthroplasty versus ankle arthrodesis: a comparative analysis of arc of movement and functional outcomes. Bone Joint J. 2016;98-B(5):634-40.
-
17Younger ASE, Wing KJ, Glazebrook M, Daniels TR, Dryden PJ, Lalonde KA, et al. Patient Expectation and Satisfaction as Measures of Operative Outcome in End-Stage Ankle Arthritis. Foot Ankle Int. 2015;36(2):123-34.
-
18Gougoulias NE, Khanna A, Maffulli N. History and evolution in total ankle arthroplasty. Br Med Bull. 2008;89(1):111-51.
-
19Schenk K, Lieske S, John M, Franke K, Mouly S, Lizee E, Neumann W. Prospective study of a cementless, mobile-bearing, third generation total ankle prosthesis. Foot Ankle Int. 2011;32(8):755-63.
-
20Piriou P, Culpan P, Mullins M, Cardon JN, Pozzi D, Judet T. Ankle Replacement versus Arthrodesis: A Comparative Gait Analysis Study. Foot Ankle Int. 2008;29(1):3-9.
-
21Roselló Añón A, Martínez Garrido I, Cervera Deval J, Herrero Mediavilla D, Sánchez González M, Vicent Carsí V. Total ankle replacement in patients with end-stage ankle osteoarthritis: clinical results and kinetic gait analysis. Foot Ankle Surg. 2014;20(3):195-200.
-
22Wood PLR, Prem H, Sutton C. Total ankle replacement: medium-term results in 200 Scandinavian total ankle replacements. J Bone Joint Surg Br. 2008;90(5):605-9.
-
23Barg A, Zwicky L, Knupp M, Henninger HB, Hintermann B. HINTEGRA Total Ankle Replacement: Survivorship Analysis in 684 Patients. J Bone Joint Surg Am. 2013 Jul 3;95(13):1175-83.
-
24Morash J, Walton DM, Glazebrook M. Ankle Arthrodesis Versus Total Ankle Arthroplasty. Foot Ankle Clin. 2017;22(2):251-66.
-
25Krause FG, Schmid T. Ankle Arthrodesis versus Total Ankle Replacement. Foot Ankle Clin. 2012;17(4):529-43.
-
26Barg A, Knupp M, Hintermann B. Simultaneous bilateral versus unilateral total ankle replacement: a patient-based comparison of pain relief, quality of life and functional outcome. J Bone Joint Surg Br. 2010;92(12):1659-63.
-
27Demetracopoulos CA, Adams SB, Queen RM, DeOrio JK, Nunley JA, Easley ME. Effect of Age on Outcomes in Total Ankle Arthroplasty. Foot Ankle Int. 2015;36(8):871-80.
-
28Kofoed H, Lundberg-Jensen A. Ankle Arthroplasty in Patients Younger and Older than 50 Years: a Prospective Series with Long-term Follow-up. Foot Ankle Int. 1999;20(8):501-6.
-
29Rodrigues-Pinto R, Muras J, Martín Oliva X, Amado P. Total ankle replacement in patients under the age of 50. Should the indications be revised? Foot Ankle Surg. 2013;19(4):229-33.
-
30Van der Heide HJL, Schutte B, Louwerens JWK, van den Hoogen FHJ, Malefijt MCW. Total ankle prostheses in rheumatoid arthropathy: Outcome in 52 patients followed for 1-9 years. Acta Orthop. 2009;80(4):440-4.
-
31Hintermann B, Barg A, Knupp M, Valderrabano V. Conversion of Painful Ankle Arthrodesis to Total Ankle Arthroplasty. Surgical technique. J Bone Joint Surg Am. 2010 Mar;92 Suppl 1 Pt 1:55-66.
-
32Hintermann B, Barg A, Knupp M, Valderrabano V. Conversion of Painful Ankle Arthrodesis to Total Ankle Arthroplasty. J Bone Joint Surg Am. 2009 Apr;91(4):850-8.
-
33Barg A, Hintermann B. Takedown of Painful Ankle Fusion and Total Ankle Replacement Using a 3-Component Ankle Prosthesis. Tech Foot Ankle Surg. 2010;9(4).
-
34Stufkens SA, Barg A, Bolliger L, Stucinskas J, Knupp M, Hintermann B. Measurement of the medial distal tibial angle. Foot Ankle Int. 2011;32(3):288-93.
-
35Terrier A, Fernandes CS, Guillemin M, Crevoisier X. Fixed and mobile-bearing total ankle prostheses: effect on tibial bone strain. Clin Biomech. 2017;48:57-62.
-
36Valderrabano V, Pagenstert GI, Müller AM, Paul J, Henninger HB, Barg A. Mobile- and fixed-bearing total ankle prostheses: is there really a difference? Foot Ankle Clin. 2012;17(4):565-85.
-
37Gaudot F, Colombier JA, Bonnin M, Judet T. A Controlled, Comparative Study of a Fixed-Bearing Versus Mobile-Bearing Ankle Arthroplasty. Foot Ankle Int. 2014;35(2):131-40.
-
38Usuelli FG, Manzi L, Brusaferri G, Neher RE, Guelfi M, Maccario C. Sagittal tibiotalar translation and clinical outcomes in mobile and fixed-bearing total ankle replacement. Foot Ankle Surg. 2017;23(2):95-101.
-
39Usuelli FG, Maccario C, Manzi L, Tan EW. Posterior Talar Shifting in Mobile-Bearing Total Ankle Replacement. Foot Ankle Int. 2016;37(3):281-7.
-
40Myerson M, Mroczek K. Perioperative Complications of Total Ankle Arthroplasty. Myerson MS (ed.). Foot Ankle Int. 2003;24(1):17-21.
-
41Queen RM, Adams SB, Viens NA, Friend JK, Easley ME, Deorio JK, Nunley JA. Differences in Outcomes Following Total Ankle Replacement in Patients with Neutral Alignment Compared with Tibiotalar Joint Malalignment. J Bone Joint Surg Am. 2013 Nov 6;95(21): 1927-34.
-
42Haskell A, Mann RA. Ankle arthroplasty with preoperative coronal plane deformity: short-term results. Clin Orthop Relat Res. 2004;(424):98-103.
-
43Dodd A, Daniels TR. Total Ankle Replacement in the Presence of Talar Varus or Valgus Deformities. Foot Ankle Clin. 2017;22(2):277-300.
-
44Lee KJ, Wang SH, Lee GW, Lee KB. Accuracy assessment of measuring component position after total ankle arthroplasty using a conventional method. J Orthop Surg Res. 2017;12(1):115.
-
45Vulcano E, Myerson MS. The painful total ankle arthroplasty. Bone Joint J. 2017;99-B(1):5-11.
-
46Hsu AR, Haddad SL, Myerson MS. Evaluation and Management of the Painful Total Ankle Arthroplasty. J Am Acad Orthop Surg. 2015;23(5):272-82.
-
47Li SY, Myerson MS. Management of Talar Component Subsidence. Foot Ankle Clin. 2017;22(2):361-89.
-
48Gross CE, Hamid KS, Green C, Easley ME, DeOrio JK, Nunley JA. Operative Wound Complications Following Total Ankle Arthroplasty. Foot Ankle Int. 2017;38(4):360-6.
-
49Patton D, Kiewiet N, Brage M. Infected total ankle arthroplasty: risk factors and treatment options. Foot Ankle Int. 2015;36(6):626-34.
-
50Devos Bevernage B, Deleu PA, Birch I, Gombault V, Maldague P, Leemrijse T. Arthroscopic Debridement After Total Ankle Arthroplasty. Foot Ankle Int. 2016;37(2):142-9.
-
51Ellington JK, Gupta S, Myerson MS. Management of failures of total ankle replacement with the agility total ankle arthroplasty. J Bone Joint Surg Am. 2013;95(23):2112-8.
-
52Kamrad I, Henricson A, Magnusson H, Carlsson Å, Rosengren BE. Outcome After Salvage Arthrodesis for Failed Total Ankle Replacement. Foot Ankle Int. 2016;37(3):255-61.
-
53Hsu AR, Haddad SL, Myerson MS. Evaluation and Management of the Painful Total Ankle Arthroplasty. J Am Acad Orthop Surg. 2015;23(5):272-82.
-
54Reiley MA. INBONE Total Ankle Replacement. Foot Ankle Spec. 2008;1(5):305-8.
-
55Kamrad I, Henricsson A, Karlsson MK, Magnusson H, Nilsson JÅ, Carlsson Å, Rosengren BE. Poor prosthesis survival and function after component exchange of total ankle prostheses. Acta Orthop. 2015;86(4):407-11.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Protocolos de la SEMCPT
- Enfermedad de Freiberg-Köhler II
- Tratamiento de fracturas diafisarias y cervicales de metatarsianos menores con enclavado endomedular anterógrado y apoyo precoz: serie de casos
- Osteotomía metatarsiana percutánea: una alternativa en el tratamiento de úlceras recurrentes o resistentes en el pie diabético
- Corrección del primer ángulo intermetatarsiano tras la artrodesis metatarsofalángica aislada versus artrodesis metatarsofalángica asociada al cierre del primer ángulo intermetatarsiano
- Aloinjerto de Aquiles tras herida por arma de fuego. A propósito de un caso
- Protocolo de artroplastia de tobillo de la SEMCPT
- Memoria de la “Beca DePuy Synthes de estancia corta en centro europeo de referencia en pie y tobillo”
- Revista de revistas
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista del pie y tobillo está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.