Protocolo diagnóstico y terapéutico de la SEMCPT para las complicaciones del pie diabético (1.ª parte)
Diagnostic and therapeutic guide of the SEMCPT for diabetic foot complications (1.st part)
ABORDAJE MULTIDICIPLINAR. ORGANIZACIÓN DE UNA UNIDAD DE PIE DIABÉTICO. COORDINACIÓN CON ATENCIÓN PRIMARIA. PAPEL DEL CIRUJANO ORTOPÉDICO. DIAGNÓSTICO Y TRATAMIENTO NO QUIRÚRGICO DEL PIE DIABÉTICO
Definición y trascendencia del pie diabético. Introducción a las complicaciones del pie diabético
El pie diabético (PD) se define como una alteración clínica de base etiopatogénica neuropática, inducida por una hiperglucemia mantenida, en la que, con o sin coexistencia de isquemia y previo desencadenante traumático, se produce una lesión y/o ulceración del pie(1). Lo hemos de entender como una enfermedad sistémica crónica, consecuencia de la hiperglucemia mantenida en el tiempo, con afectación de otros órganos (nefropatía, retinopatía...).
La diabetes mellitus (DM) es una enfermedad endocrina con gran prevalencia en todo el mundo y que puede llegar a considerarse una verdadera epidemia del siglo XXI. En el año 2014 en el mundo había 422 millones de diabéticos y, actualmente, casi el 10% de la población la padece. Se prevé que los pacientes diabéticos en el mundo asciendan a 552 millones en el año 2030(2). En el año 2012 supuso un total de 3,7 millones de muertes.
No todos los pacientes diabéticos van a presentar problemas en sus pies. Se considera que un 15% de ellos, en algún momento de su vida, presentarán una úlcera y, de estos, un 25% precisará algún tipo de amputación. El objetivo principal en la atención de los pies de los pacientes afectos de DM es evitar una amputación mayor, como la infracondílea(3).
Dada la afectación sistémica que conlleva esta patología, con diferentes órganos diana, así como la compleja etiopatogenia de esta enfermedad endocrina, la mejor manera de abordar las complicaciones acaecidas en los pies de los diabéticos es de forma multidisciplinaria. Son diferentes los estudios internacionales que ya han demostrado que, atendiendo a estos pacientes en equipo, el número de amputaciones es mucho menor (disminuyen de media entre un 50 y un 70%)(4).
Igualmente, atender las complicaciones en los pies de los diabéticos será un reto. Con la progresión de la enfermedad, la neuropatía y/o la isquemia comportarán, en ciertos casos, una serie de procesos patológicos (complicaciones o lesiones). Estos pueden presentarse de forma aislada o combinada y, por otro lado, no tienen que seguir un patrón cronológico concreto. Nos referimos a las siguientes entidades(5):
- Úlceras.
- Alteraciones mecánicas (deformidades).
- Infecciones (óseas y/o de partes blandas).
- Neuroartropatía de Charcot.
Pie de riesgo. Cribaje del pie diabético. Modelos y nivel de atención
No todos los pacientes diabéticos, en un momento determinado de la evolución de su enfermedad, tienen el mismo riesgo de sufrir una lesión en sus pies. Y el mismo paciente, a lo largo del tiempo, puede ir progresando en su nivel de riesgo de sufrir una complicación, al ir presentando neuropatía y/o isquemia progresiva.
Los factores etiopatogénicos a tener en cuenta para catalogar el tipo de riesgo lesional son:
- Neuropatía.
- Vasculopatía.
- Deformidad y rigidez.
- Úlcera previa o cambios cutáneos actuales.
- Complicaciones del otro pie (Charcot, amputaciones...).
Se definen 3 niveles de riesgo lesional(6) hasta llegar al PD propiamente dicho, es decir, el que ya presenta alguna de las lesiones descritas con anterioridad:
- Bajo riesgo.
- Riesgo moderado o intermedio.
- Alto riesgo.
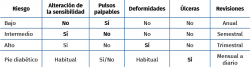
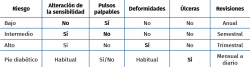
En función del nivel de riesgo, la atención que precisará cada paciente cambiará, tanto en frecuencia (regularidad de los controles), como en el nivel de complejidad asistencial (centro de atención primaria –CAP– o centro hospitalario) (Tabla 1).
El paciente de bajo riesgo tiene la sensibilidad conservada y pulsos presentes; con un control anual por parte de podología o atención primaria (AP) será suficiente. En el riesgo moderado el paciente presenta en sus pies neuropatía, ausencia de pulsos distales u otro factor de riesgo. Cada 3 a 6 meses habrá de realizar una visita de control preventivo. Y el pie de alto riesgo se define por la presencia de neuropatía o pulsos ausentes, junto a deformidad, cambios en la piel o úlcera previa. Cada 1 a 3 meses máximo deberá seguir un control. El PD propiamente dicho será el que presente úlcera y necesitará un tratamiento individualizado.
Para catalogar el pie de riesgo (cribaje), en función de los factores que hemos mencionado, es imprescindible una buena anamnesis, así como una exploración básica y específica de los pacientes diabéticos.
En la recogida de los datos es muy importante anotar todos los factores de riesgo cardiovascular que puedan interferir en los procesos de curación de las lesiones del PD, como la hipertensión, el tabaquismo o la dislipemia. También debe constar el tiempo de evolución de la diabetes, así como el tratamiento que realiza el paciente. Debemos anotar la última hemoglobina glicosilada (HbA1c > 7-8% indica un mal control de la diabetes), así como el grado de colaboración del paciente y su familia. Deben registrarse todos los procesos y tratamientos previos al episodio actual que se refieran a complicaciones del PD, como úlceras, celulitis, amputaciones, clínica sugestiva de neuropatía, vasculopatía o pie de Charcot.
La neuropatía se manifiesta habitualmente como una polineuropatía simétrica distal, con afectación sensitiva, motora y/o vegetativa. La exploración debe encaminarse a conocer la sensibilidad profunda protectora en los PD. La exploración más empleada habitualmente para ello es el monofilamento de Semmes-Weinstein (habitualmente de 10 g). Se deben explorar 10 puntos, en la planta y también algunos en el dorso, para conocer la capacidad de protección del pie. También se puede valorar la sensibilidad táctil profunda con el diapasón (de 128 Hz) en el ápex del hallux. Ambas exploraciones pueden identificar al 87% de los pacientes con pérdida de sensibilidad protectora en los pies de riesgo de ulceración(7).
El examen con el monofilamento identifica a pacientes con “alto” riesgo de ulceración con una sensibilidad del 66 al 91% y una especificidad del 34 al 86%, según los diferentes estudios realizados. Aunque se describen hasta 10 zonas a explorar en el pie, los puntos básicos que se deben valorar son el pulpejo del hallux y la zona plantar correspondiente a las cabezas del primer y el quinto metatarsianos.
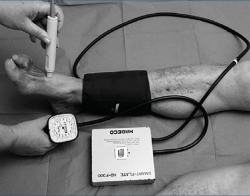
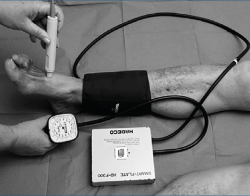
La vasculopatía puede afectar la irrigación de los pies. Puede ser una micro- o macroangiopatía que comporte un mayor o menor grado de isquemia distal. Además de los pulsos pedio y tibial (también es aconsejable valorar los proximales como el femoral y el poplíteo), la exploración más utilizada es el índice tobillo-brazo (ITB) (Figura 1).
Compara la diferencia entre la tensión arterial en la extremidad superior e inferior (mediante esfigmomanómetro y Doppler, habitualmente). Este índice debería estar alrededor de 1. Cuando está por debajo de 0,9 es patológico, pero es especialmente grave por debajo de 0,5 (isquemia crítica). Mientras que un ITB superior a 1,1 puede representar una presión falsamente elevada producida por calcificaciones arteriales. Es por ello que ciertos profesionales calculan la presión en el hallux y no en tobillo. El test es fácil de realizar para el cirujano vascular (también por enfermería y podólogos experimentados), siendo objetivo y reproducible. También se utiliza la medición transcutánea de la presión parcial de oxígeno (TcPO2 > 60 mmHg sería normal y se define una isquemia crítica por debajo de 30).
La combinación de dolor en las pantorrillas al caminar, ausencia de pulsos periféricos y un ITB < 0,9 predice la presencia de arteriopatía periférica con el 95% de sensibilidad y especificidad en estos pacientes(8).
La presencia de deformidad y rigidez del pie nos permite entender la dificultad de adaptación al terreno, al calzado y a los soportes plantares (plantillas). Hay que hacer una exploración básica en sedestación y bipedestación de los PD. Con la inspección (también en carga), la palpación y la movilización del pie y el tobillo valoraremos si existe un apoyo plantígrado correcto, con una flexibilidad adecuada de adaptación al suelo. O si, por otro lado, tenemos una rigidez y deformidad importantes no acomodativas, que ponen en riesgo al paciente. Por ello, debemos valorar si existen cambios cutáneos por rozadura y/o bursitis, especialmente si son progresivas.
Las queratosis sin ulceración ni signos flogóticos nos informan de las zonas de presión inadecuada a la marcha. La valoración de su situación en la planta debe ser analizada desde el punto de vista mecánico y nos permitirá diferenciar en qué fase de la marcha se produce el “conflicto”. Pero también pueden sugerir estadios iniciales de la neuropatía, por lo que debemos seguir su evolución(9).
Los cambios cutáneos previos y los antecedentes de úlceras nos informan sobre el compromiso de la barrera de protección cutánea, con o sin deformidad obvia. Deberemos catalogar el tipo de úlcera como neuropática, vascular o mixta, así como cuantificar su grado (profundidad, componente de infección, afectación de estructuras profundas...) con las diferentes clasificaciones al efecto.
La forma de ulceración más frecuente en el PD es la neuropática (45-60%). También puede haber úlceras isquémicas (10-15%) y formas mixtas (neuroisquémicas). Los rasgos más característicos para diferenciar las úlceras isquémicas de las neuropáticas son los siguientes:
• Neuropática:
– En una zona de presión (por ejemplo, bajo la cabeza de M1).
– Circular, bien delimitada.
– Con hiperqueratosis en los bordes; en “sacabocados”.
– Con frecuencia exudativa y granulación en el fondo.
– Sin dolor (o poco dolor).
• Isquémica:
– En el talón, la punta de los dedos, el borde lateral, los maléolos.
– Irregular, con la piel de alrededor fina/brillante.
– Poco exudativa y sin tejido de granulación.
– Dolorosa (peor en decúbito supino/reposo).
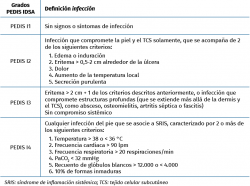
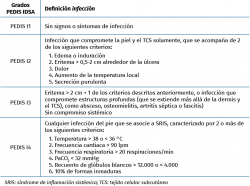
Existen diferentes clasificaciones para catalogar la gravedad de las úlceras en el PD, que valoran el tamaño, la profundidad, la infección… Las más utilizadas son la de Wagner y la de la Universidad de Texas(10,11,12), aunque una de las más completas es la PEDIS(13); ésta nos permite incluso definir criterios de ingreso en casos severos, en función del grado de infección, pues cataloga no solo la afectación local, sino también la repercusión sistémica (Tablas 2 a 4). PEDIS considera 5 subclasificaciones, cuyas iniciales forman la sigla que le da nombre:
- P, perfusión.
- E, extensión.
- D, deep (profundidad).
- I, infección.
- S, sensación.
Las complicaciones severas en el otro pie, como Charcot o amputaciones, nos pueden indicar el nivel de control de la enfermedad. Deberemos dejar constancia del nivel y la fecha de la amputación contralateral, así como la fase, la localización y el grado de deformidad de la neuroartropatía. También anotaremos los tratamientos que ha precisado en el otro pie, afecto de Charcot, y su evolución.
Para describir los modelos clínicos y el nivel de atención, debemos referirnos a Leavell y Clark(14), que definieron en 1965 los clásicos 3 niveles de prevención:
- Primaria, para evitar ocurrencias.
- Secundaria, para evitar progresión.
- Terciaria, para evitar complicaciones.
La prevención primaria promueve el autocuidado, brindando información a la población sobre hábitos de vida saludable (además de protección específica). La prevención secundaria promueve el diagnóstico precoz y el tratamiento inmediato de los problemas que surjan en los pies de estos pacientes (limitaría el daño). Y, por último, la prevención terciaria ofrece el control y el tratamiento de las complicaciones; así, evita lesiones “mayores”, que puedan comprometer la pérdida de la extremidad o incluso la vida.
Las modalidades de prevención se desarrollarán en diferentes ámbitos clínicos. Así la prevención primaria y la secundaria suelen estar ubicadas en los centros de salud. Allí, los equipos de AP, con médicos y enfermería especializada (además de podólogos, si existen en la cartera de servicios), tienen como objetivo promover la salud, diagnosticar de forma temprana las lesiones y aplicar el tratamiento precoz para su solución.
La prevención terciaria suele localizarse en centros hospitalarios, donde existen profesionales que se dedican al tratamiento de las complicaciones acaecidas en los PD.
Organización de una unidad de pie diabético (UPD). Profesionales que la integran y coordinación del equipo
En el abordaje del PD existen internacionalmente aceptados 3 modelos de atención(15):
- Modelo mínimo (básico) o nivel 1.
- Modelo intermedio o nivel 2.
- Centros terciarios de referencia (nivel 3) o centros de excelencia.
El modelo de nivel 1 o básico está integrado por un médico de familia, un/a enfermero/a especializado/a en diabetes y en el cuidado-curas de los pies, así como, de forma ideal, por un podólogo. Debe ofrecer habilidades en el examen y la detección de problemas del PD, cribaje básico del pie de riesgo, tratamiento de los problemas leves de los pies, así como aportar educación preventiva a estos pacientes.
El modelo de nivel 2 lo integran un endocrinólogo, un cirujano (ortopédico, vascular y/o general), un podólogo y un/a enfermero/a especializado/a en diabetes. Puede estar localizado en un CAP o bien en un centro hospitalario. Aquí, además de las atenciones que ofrece un nivel 1, deben tratar todo tipo de úlceras y de infecciones de forma ambulatoria, así como aportar al paciente las herramientas para su autocuidado.
El modelo de nivel 3 se localiza en un centro hospitalario, especializado en el pie, con múltiples disciplinas dedicadas al cuidado del PD. No solo va a tener la capacitación para el óptimo diagnóstico y tratamiento de todas las complicaciones del PD, sino que también jugará un papel vital en la formación de los profesionales de su área de influencia. Debe tener una comunicación próxima y fluida con los CAP de su ámbito de trabajo; la persona de enlace o “gestor/a de casos” se encarga de la comunicación entre el centro de excelencia y la AP. Ello permite una coordinación rápida y efectiva entre centros, en beneficio de los pacientes.
Además, el modelo avanzado se encargará de organizar eventos de formación y seguirá proyectos de investigación. Debe incluir diferentes especialistas, entre los que son básicos un endocrinólogo, un cirujano ortopédico y vascular, un radiólogo intervencionista, el Servicio de Microbiología y un especialista en infecciones, un podólogo y un equipo de enfermería especializado en curas y educación para los diabéticos. El equipamiento tiene que ir en consonancia con todos los procesos diagnósticos y procedimientos terapéuticos que deben realizarse ante las complicaciones más temibles que pueden acaecer en los PD. El objetivo principal del modelo de excelencia será minimizar el porcentaje de amputaciones, incluso en los problemas complejos de los PD.
La atención multidisciplinaria del PD no significa que el paciente acuda a una consulta, urgencias o bien ingrese en un servicio y a continuación se realicen una serie de interconsultas que la mayoría de las veces contestan profesionales que no están integrados en la unidad ni muestran interés en esta patología(16). La atención coordinada entre los profesionales debe adherirse a los criterios actuales basados en evidencias científicas. Las UPD deben estar formadas por profesionales implicados, adecuadamente formados y actualizados, que comparten los mismos criterios, que se reúnen para discutir sobre las opciones terapéuticas de un caso concreto y que siguen las recomendaciones de los consensos internacionales (aunque tengan protocolos propios en función de las recomendaciones científicas constatadas). Los profesionales deben tener competencia y habilidades específicas sobre el proceso a tratar y esto, a veces, va más allá de la especialidad que se tenga. Cirujanos ortopédicos que puedan reconstruir un pie de Charcot, cirujanos vasculares y radiólogos intervencionistas con experiencia en revascularizaciones distales, personal de enfermería con conocimiento de las dificultades en el proceso de cicatrización… y todos aquellos que sean necesarios para el equipo. Necesitarán una formación específica en PD y, si no la tienen, deben estar dispuestos a adquirirla.
Muy importante es también el papel del coordinador de la UPD. Debe ser una persona asertiva, creativa y entusiasta, que inspire al equipo. Evidentemente, tiene que conocer la patología de los pacientes a tratar, pero su especialidad no es lo más importante, sí su dedicación. Puede ser un cirujano vascular u ortopédico, endocrinólogo, podólogo…
Además, existen unas rutas asistenciales y guías clínicas para los pacientes hospitalizados o atendidos en urgencias, bien sean derivados desde la unidad o bien como casos nuevos. Se realizan interconsultas hospitalarias desde el primer momento a la unidad, para tener controlados a los pacientes ingresados en urgencias o en planta. Esto, junto a la comunicación vía móvil, nos permite de forma rápida conocer las incidencias diarias en cuanto a los pacientes ingresados y así optimizar su tratamiento.
Criterios y rutas de derivación a las unidades de pie diabético. Coordinación entre la atención primaria y la hospitalaria
Los criterios de derivación a unidades especializadas de PD pueden variar según el área de influencia y los medios disponibles. Así, a nivel nacional hay unos documentos de consenso sobre esos criterios de derivación. En España podemos considerar el documento de consenso sobre PD de la Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC)(17) y la Sociedad Española de Angiología y Cirugía Vascular (SEACV)(18). Luego hay documentos regionales que también pueden perfilar esos criterios, como sucede en nuestro centro.
A nuestra UPD solo acudirán enfermos que presenten úlceras, aunque estas no sean complejas (superficiales sin isquemia) según los criterios a continuación descritos, que no se estén resolviendo fácilmente desde AP(19). No se admitirán pacientes sin úlcera, aunque sea un pie de riesgo, excepto para la artropatía de Charcot.
Derivación a la Unidad de Pie Diabético
Derivación ordinaria
- Úlceras superficiales sin isquemia ni infección en pacientes con hiperglucemia franca o muy mal control de la diabetes.
- Úlceras superficiales con pulsos presentes y sin infección en pacientes con neuropatía o deformidad importante, que no mejoran con los tratamientos indicados por AP en un mes o son recurrentes.
Derivación preferente (entre 1 semana y 1 mes)
- Úlceras superficiales sin signos de infección con vasculopatía.
- Úlceras superficiales con celulitis de menos de 2 cm, sin afectación sistémica (fiebre, malestar general).
- Úlceras profundas que afectan tendones, la cápsula articular o el hueso, o necrosis seca, sin signos de infección o vasculopatía.
- Úlceras profundas con sospecha de osteomielitis (OM).
- Úlceras profundas que afectan tendones, la cápsula articular o el hueso, o necrosis seca con vasculopatía.
- Sospecha de artropatía de Charcot, especialmente aguda.
Es importante remarcar que el paciente ha de estar hemodinámicamente estable, sin afectación del estado general y sin fiebre para poder ser atendido en la unidad.
Urgencias
- Úlceras superficiales con celulitis de más de 2 cm (IDSA 3 -Infectious Disease Society of America- de la clasificación PEDIS) o afectación sistémica (IDSA 4 de la clasificación PEDIS).
- Úlceras profundas con absceso y sospecha de OM o artritis.
- Gangrena húmeda.
Los pacientes atendidos en la UPD habrán de cumplir los criterios descritos y la visita en consulta habrá de ser validada por el/la gestor/a de casos. Dicho profesional coordina las visitas del paciente con su médico y otros miembros del equipo, y promueve la responsabilidad y la participación del paciente en su plan de curas. Por tanto, asegura una buena adherencia del paciente a las recomendaciones que requiere su enfermedad. El/La gestor/a de casos también coordina los “procesos”, hace seguimiento de los cuidadores y de los proveedores de servicios, para asegurar que el plan establecido se desarrolla de forma adecuada. También hará de enlace con AP para facilitar la comunicación bidireccional entre los dos ámbitos; así, podrá también facilitar el retorno del paciente, una vez solucionado su problemática, desde la UPD a AP.
Las condiciones para el retorno a AP del paciente, una vez controlada su patología, conllevan:
- Contacto del gestor de casos de la UPD con el profesional de enfermería de contacto de asistencia primaria, gestor o no.
- Valorar las posibilidades de autocura, por un familiar o bien mediante atención a domicilio.
- Explicación del proceso por el que ha estado derivado, si ha finalizado, y, si no ha finalizado dicho proceso, si reúne criterios asumibles de curas y seguimiento en AP.
Utilidad del abordaje multidisciplinario. Objetivos que cumplir. Las unidades de pie diabético en España
Hay diversas publicaciones internacionales que reflejan una drástica reducción de las amputaciones mayores del PD desde la implementación de unidades multidisciplinarias(20,21,22). Por lo tanto, el objetivo principal de las UPD es la disminución del número de amputaciones. Pero esta no debe ser la única meta. También debe reducirse el número de ingresos por urgencias y el tiempo de hospitalización, mejorar la calidad de vida de estos pacientes y reducir la espera para las exploraciones (a ser posible condensadas el mismo día) y los tratamientos.
Pero también es importante la reducción del gasto sanitario. La educación extensa del paciente, la evaluación temprana y el tratamiento agresivo por un equipo multidisciplinario representan el mejor enfoque para tratar a los pacientes de alto riesgo con diabetes. Los resultados clínicos y económicos demuestran una reducción en el número de amputaciones, la duración de la estancia y de los costes(23).
Para todo ello, es vital presentar unas habilidades esenciales en el equipo, que faciliten llegar a los objetivos marcados de forma rápida y efectiva(24):
- Realizar la evaluación vascular hemodinámica y anatómica con revascularización, cuando sea necesario.
- Realizar un estudio neurológico adecuado.
- Realizar una técnica de cultivo apropiada para la zona afecta.
- Realizar la evaluación de la herida y la estadificación/clasificación de la infección y la isquemia.
- Realizar incisiones y desbridamientos intrahospitalarios en el quirófano y en las curas a pie de cama, de los sitios específicos, así como las descargas pertinentes. Cirugía ortopédica pertinente.
- Iniciar y modificar la antibioticoterapia específica según los cultivos y la situación del paciente.
- Realizar monitorización postoperatoria adecuada para reducir el riesgo de reulceración e infección.
Si el conjunto de los profesionales de la UPD no es capaz de conseguir estas pautas de funcionamiento de forma dinámica, quizás no está en condiciones de constituirse como un modelo de excelencia y, por tanto, no podrá llegar a los objetivos deseables.
En nuestro país se publicó en 2014 una encuesta realizada a nivel nacional para conocer cómo se atiende en España a los enfermos diabéticos con problemas en los pies(25). Se constató que solo el 45% tiene atención especializada (dando cobertura solo al 25% de los diabéticos nacionales). Pero dicha atención solo en el 26,5% es avanzada (modelo de excelencia). En los equipos de PD eran unos 6 profesionales de media por unidad, con predominio de endocrinología, cirugía vascular y enfermería. Solo el 58% contaba con cirujano vascular y podólogo, siendo el coordinador más habitual del Servicio de Endocrinología.
En la encuesta realizada a través de la Sociedad Española de Medicina y Cirugía del Pie y Tobillo (SEMCPT) en 2017, de los 66 centros que contestaron, solo 25 (38%) tenían UPD. Solo en 7 casos el coordinador pertenecía al Servicio de Cirugía Ortopédica y Traumatología, con predominio en el resto de los cirujanos vasculares y endocrinólogos como responsables. De todos modos, el traumatólogo tiene cada vez más peso específico en las UPD, respecto al resto de las especialidades médicas y/o quirúrgicas.
Procesos clínicos como complicaciones de los pies diabéticos. Enfoque práctico
Úlceras
Ya han sido suficientemente desarrolladas en el apartado de pie de riesgo, donde se han descrito sus diferentes tipos y grados según las clasificaciones más utilizadas.
Alteraciones mecánicas
Consideramos deformidades características del PD las garras rígidas con piel seca y atrofia de la musculatura intrínseca, por la afectación nerviosa de la enfermedad. Asimismo, es común el equinismo por afectación del tendón aquíleo. También un pie plano por una neuroartropatía de Charcot, en su fase crónica. Además, podemos encontrar deformidades comunes a pacientes no diabéticos, como un hallux valgus.
Infecciones
Pie agudo en urgencias
Este tipo de infección, junto con la isquemia aguda, son los 2 procesos más graves y que precisan una actuación de mayor celeridad en el PD (emergencia). Sus consecuencias pueden ser fatales, con peligro de pérdida de la extremidad e incluso de la vida.
Además de los signos clásicos locales de inflamación, podemos objetivar fluctuación, crepitación, cambios de sufrimiento cutáneo e incluso fistulización. No es infrecuente la coexistencia de una úlcera, que puede actuar como puerta de entrada, así como necrosis tisular, más o menos extensa. Son imprescindibles los estudios con radiografía y una analítica sanguínea. Se puede solicitar también una ecografía (con punción dirigida) y hemocultivos para completar el estudio.
Deberemos tomar buenas muestras para microbiología, en profundidad, no de la úlcera o de otra puerta de entrada, donde pueda coexistir contaminación.
Criterios de ingreso serían la afectación sistémica (IDSA 4 de la clasificación PEDIS, que también se refleja como PEDIS I4), la necesidad de desbridamiento amplio y/o las infecciones necrotizantes.
Osteomielitis
La infección subaguda o cronificada (con frecuencia recidivante) del PD, con afectación osteoarticular en forma de osteítis y/o artritis es un reto. Suele coexistir una úlcera o ha estado presente previamente. Un dedo “en salchicha” (dactilitis), con edema y eritema, sugiere osteoartritis. Una prueba objetiva de infección es la palpación de hueso desde la úlcera (probe-to-bone –PTB–)(26) y evidentemente el aislamiento de un mismo germen por cultivo de diferentes áreas y estructuras, que no provengan de la propia úlcera (sino de la “profundidad”).
Aquí la evolución en las radiografías, la resonancia magnética (RM) y/o la gammagrafía (con leucocitos) nos informa de la extensión de la infección a los planos profundos y permitirá una planificación del tratamiento. Puede ser difícil diferenciar este cuadro de una fase inicial de la neuroartropatía de Charcot.
Microbiología
En las infecciones “leves” o en episodios iniciales, suelen predominar los cocos aerobios Gram positivos (CGP), como Staphylococcus aureus. Las infecciones “graves” o más cronificadas suelen ser polimicrobianas, con presencia tanto de gérmenes aerobios como anaerobios y con un mayor protagonismo de bacilos Gram negativos (especialmente enterobacterias). En infecciones previamente tratadas o recidivantes en contacto con el ámbito hospitalario o sin él, pueden aparecer microorganismos seleccionados multirresistentes o de difícil tratamiento (Pseudomonas aeruginosa, enterobacterias productoras de betalactamasas de espectro extendido, enterococos...). En infecciones profundas y con necrosis (isquemia) podemos aislar anaerobios, aunque normalmente con otros gérmenes aerobios (mixta)(27).
Exploraciones complementarias
Las osteólisis metafisodiafisarias en las radiografías son sugestivas de osteítis, especialmente en el antepié. En casos de alta sospecha, con ausencia de signos sugestivos en las radiografías iniciales, es conveniente repetirlas a las 2 semanas, cuando ya puede ser visible la osteólisis que inicialmente no se observaba.
La RM, especialmente con gadolinio, nos permite un diagnóstico fiable de la OM, incluso diferenciable de las afectaciones de la neuroartropatía(28). Sería pues de elección ante la sospecha de infección profunda, con extensión a vainas tendinosas y otros espacios anatómicos, sirviendo de guía para la planificación quirúrgica.
La ecografía nos será útil en manos expertas para determinar la extensión de las lesiones menos profundas, puncionar abscesos y apreciar osteólisis cortical; por tanto, será una exploración a tener en cuenta en el pie con infección aguda (urgencias).
La gammagrafía con leucocitos marcados puede sernos de utilidad en casos dudosos y para delimitar una extensión anatómica concreta, especialmente la tomografía computarizada por emisión de fotón único (SPECT)-tomografía computarizada (TC)(29).
La radiografía posteroanterior y oblicua se debe realizar aun sin clínica añadida y tiene una sensibilidad del 63% y una especificidad del 80% para identificar lesiones óseas en los grados clínicos 0 y 1 de la escala de Wagner. Sin embargo, en los grados de 2 a 5 si la exploración radiográfica no es concluyente y existe la sospecha de osteítis u OM se debe realizar TC, RM o gammagrafía.
La sensibilidad y la especificidad de la RM para detectar lesiones precoces alcanza un 88 y un 93%, respectivamente(18).
Pie de Charcot
Definición
Es aún hoy en día una complicación mal comprendida y con frecuencia descuidada de la diabetes. La neuropatía evolucionada comporta una pérdida de la sensibilidad protectora, junto a una falta de control vasomotor. Así es como en algunos pacientes se inicia un mecanismo evolutivo de fragmentación y reabsorción osteoarticular, que comporta grandes deformidades del pie y del tobillo.
Epidemiología de la neuroartropatía
Suele afectar a pacientes diabéticos con más de 10 años de evolución de su enfermedad. La incidencia es de un 15%, en personas habitualmente entre 40 y 60 años, con polineuropatía simétrica distal. Solo es bilateral en el 20% de los casos, pero se comporta habitualmente de forma asimétrica. La zona que más se afecta es el tarso y el 40% de los afectados de la neuroartropatía se ulcerarán.
Curso de la enfermedad
Los estadios de la enfermedad están descritos en la clasificación de Eichenholtz(30), que diferencia 3 etapas progresivas. Una primera (I) de destrucción y fragmentación osteoarticular que, si no es bien controlada, puede conllevar una gran desestructuración del pie y el tobillo. Después, una segunda fase (II) de coalescencia, subaguda, en la que, finalizando los fenómenos de destrucción inicial, coexisten los procesos de cicatrización. Y, finalmente, una última etapa (fase III), crónica, de remodelado.
En la fase I (activa), el pie está tumefacto y eritematoso, con fenómenos de reabsorción ósea y destrucción de las articulaciones; podemos encontrar luxaciones y fracturas. Puede ser dolorosa y obliga al diagnóstico diferencial con un proceso de infección (OM).
En las fases II y III (no activas), cada vez el pie está con menos signos flogóticos y el paciente con menos dolor (puede estar ausente); sin el tratamiento adecuado, el pie puede estar muy deformado y con gran desestructuración en las radiografías. Son típicas las lesiones destructivas en el tarso, con hundimiento del pie, adquiriendo el aspecto en balancín.
Topografía
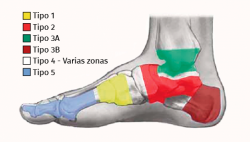
Hay diversas clasificaciones en función de la zona anatómica preferentemente afectada. Una muy empleada es la de Sanders, que diferencia 5 localizaciones(31):
I. Articulaciones metatarsofalángicas/falanges.
II. Articulación tarsometatarsiana (Lisfranc).
III. Articulación de Chopart (talonavicular y calcaneocuboidea).
IV. Articulación subtalar y tobillo.
V. Calcáneo.
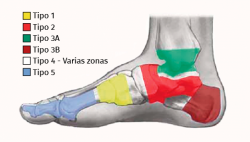
Las zonas más afectadas son las articulaciones de Lisfranc (un 40%) y Chopart (30%). También es muy empleada la clasificación anatómica de Brodsky (Figura 2)(32).
Tratamiento médico y ortopédico de las afecciones del pie diabético
Prevención en el pie de riesgo
La prevención primaria comienza discerniendo si estamos ante un pie de riesgo o no, y su grado. La secundaria o en los pacientes de riesgo consistirá en la educación, los controles rutinarios y en medidas ortopodológicas. El papel del/la educador/a especializado/a en diabetes y cuidado de los pies será vital, junto con las revisiones médicas pertinentes (y del equipo de enfermería).
Calzado y soportes plantares
El calzado debe ser adaptado a las deformidades, sin costuras y, en ciertos casos, a medida. Los soportes plantares (plantillas) bien diseñados pueden cumplir una función preventiva básica. El seguimiento del podólogo especializado en el campo del PD permitirá detectar precozmente las zonas de peligro de ulceración y modificar pertinentemente las plantillas y/o el calzado.
Si a pesar de un buen tratamiento ortopodológico, las deformidades no se controlan y tenemos riesgo de ulceración (bursitis, eritema…), puede estar indicado un tratamiento quirúrgico ortopédico preventivo (con fines curativos)(33). El objetivo será obtener un pie estable y con apoyo plantígrado.
Úlceras sin osteítis (osteomielitis)
Estas lesiones son habitualmente tratadas sin cirugía en la unidad básica de PD. Corresponden normalmente a lesiones poco profundas.
Descarga y curas locales
La descarga es el primer aspecto que hay que conseguir para favorecer la cura de la úlcera. Si bien el yeso de contacto total (YCT)(34) es el tratamiento de referencia para las úlceras y la enfermedad de Charcot en fase aguda, cada vez existen más dispositivos ortopédicos para conseguir una descarga selectiva. Además, estos tendrán la ventaja de su fácil retirada para realizar las curas. Pueden ir desde un zapato postoperatorio, con suela rígida (o mejor de talón invertido para descargar el antepié), hasta las botas Walker con cámara de aire y con diferentes tipos de “plantillas” o fieltros que se adaptan para descargar la zona ulcerada.
La cura se basará en desbridar el tejido necrótico, evitar la progresión de la úlcera y una posible infección en profundidad, así como favorecer el cierre de la misma. Para ello, además de la utilidad del desbridamiento mecánico con bisturí, disponemos de diferentes apósitos y productos que nos permitirán, en un ambiente habitualmente húmedo, desbridar, desinfectar, favorecer la granulación y epidermizar.
Ante curas dificultosas tenemos la opción de la cura por vacío o terapia de presión negativa (TPN, habitualmente conocida como VAC) y las cámaras hiperbáricas (y también actualmente normobáricas), que favorecen la neovascularización acelerando la curación.
Cirugía ortopédica
Ante la falta de respuesta en la curación de las úlceras, diferentes procedimientos ortopédicos habrán de valorarse. Ante un equinismo con ulceración en el antepié, deberemos valorar un alargamiento del tendón aquíleo (o un alargamiento del gastrocnemio medial). También podemos reducir la presión debajo de la cabeza de un metatarsiano donde se generó la úlcera, realizando una osteotomía de elevación. Puede ser necesaria la colaboración del cirujano plástico, en caso de que se trate de grandes defectos de cobertura.
Úlceras con osteítis
Suele realizarse el tratamiento hospitalizado y con el apoyo del equipo de medicina interna/infecciosas. Además, será muy importante el buen control de la glucemia.
Antibioticoterapia
Es esencial obtener unas buenas muestras para cultivo e identificar la/s bacteria/s implicada/s. Para ello, además de obtener tejido de la profundidad por biopsia, es importante que el paciente no lleve tratamiento antibiótico previo (o que al menos se haya suspendido entre 5 y 7 días antes).
Desbridamiento y resección ósea
Los principios del tratamiento quirúrgico de las osteítis deben ser estrictos en el PD, con la resección de todo el tejido desvitalizado, pero teniendo en cuenta los conceptos mecánicos, para no generar un problema futuro en la función del mismo. En el antepié se pueden realizar resecciones/artroplastia en los dedos, incluso en la primera metatarsofalángica (aunque recomendamos la artrodesis). Podemos realizar una amputación menor (de un dedo o de todo el radio).
En los casos graves, donde exista un compromiso vascular crítico e incluso riesgo vital, puede estar indicada una amputación al nivel del mediopié o el retropié. La amputación transmetatarsal es un buen procedimiento si no es salvable el antepié. El resto de las amputaciones proximales del pie son técnicamente exigentes, más difíciles de protetizar en el caso del tobillo y menos aceptadas por el paciente. Por ello, se suele emplear la amputación infracondílea. Otra opción, en ciertos casos, sería la amputación de Syme (desarticulación del tobillo).
Pie agudo infectado
Es una emergencia por la infección en profundidad (PEDIS I3) e incluso la afectación sistémica que puede existir (PEDIS I4)(35). Fístula, absceso, necrosis, isquemia, crepitación… con o sin osteólisis y dolor variable. El conocimiento de los espacios anatómicos por donde puede discurrir la infección, así como de las técnicas de amputación, es imprescindible para abordar estas graves lesiones. Debemos hacer siempre una valoración del estado vascular previo, para decidir cuál es el tratamiento más adecuado.
Actuación en urgencias
Una vez tomadas muestras para microbiología, se iniciará antibioticoterapia intravenosa empírica. Habitualmente, se emplea amoxicilina y ácido clavulánico junto a gentamicina o quinolonas. Otras opciones, en casos más severos, pueden ser la piperacilina-tazobactam, la teicoplanina o el imipenem(36).
Desbridamiento y amputaciones
Deben realizarse los abordajes necesarios para desbridar todo el tejido necrótico y el contenido purulento, dejando bien drenados los diferentes espacios anatómicos. La incisión plantar debe ir desde la punta del maléolo tibial hacia distal, siguiendo el trayecto de la infección, escindiendo los compartimentos afectos (central, medial o lateral). Este abordaje se denomina de Loeffler y Ballard. Habitualmente, la incisión va centrada en el segundo espacio y finaliza entre la primera y la segunda cabezas metatarsales, aunque se modifica según lo necesario.
Ante la falta de viabilidad de un dedo o de todo un radio, podemos realizar una amputación del mismo. Es recomendable dejar abiertos parcialmente estos abordajes, con las estructuras nobles, como los tendones, a ser posible cubiertas.
En ciertos casos graves puede ser necesaria una amputación mayor, pero es aconsejable realizar un desbridamiento amplio y revalorar a las 48 horas. En casos de defectos de cobertura, puede ser necesaria la colaboración del cirujano plástico.
Neuroartropatía de Charcot
Tratamiento ortopodológico
El tratamiento precoz en las fases iniciales de la neuroartropatía permitirá evitar la deformidad del pie. La descarga y la contención en la fase aguda será vital; además, el tratamiento se alargará varios meses, hasta que la enfermedad llegue a una fase III de remodelado(37). La contención con botas Walker u otras ortesis similares como la bota CROW (Charcot restraint orthotic walker) o el YCT debe seguir un control estricto por los profesionales, para evitar el fracaso del tratamiento.
Opciones quirúrgicas
Si fracasa el tratamiento ortopédico, la deformidad más grave y habitual será el pie plano. Si es inestable a la exploración física y presenta zonas de compromiso cutáneo e incluso ulceración “resistente”, deberemos plantear el tratamiento quirúrgico.
El objetivo final es evitar una amputación, pero nuestra intención se basará en conseguir un:
- Pie estable.
- Plantígrado (acomodable a una ortesis-calzado).
- “Funcional”.
Tablas
Tabla 4. Escala IDSA (Sociedad Americana de Enfermedades Infecciosas) para valorar la infección de los pies diabéticos, dentro de la clasificación PEDIS
Figuras
Información del artículo
Cita bibliográfica
Autores
Albert Pérez Fernández
Equipo de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario de Bellvitge, Hospitalet de Llobregat, España
Magdalena Edo Llobet
Unidad de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Fundacio Althaia - Xarxa Asistencial Universitaria de Manresa. Barcelona
Unidad de Pie y Tobillo. Hospital Universitari Bellvitge. L’Hospitalet de Llobregat, Barcelona
Elena Cañas Miguel
Equipo de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario de Bellvitge. Universidad de Barcelona. L’Hospitalet de Llobregat, Barcelona
Óscar Pablos González
Equipo de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario de Bellvitge. Universidad de Barcelona. L’Hospitalet de Llobregat, Barcelona
Juan Manuel Ríos Ruh
Servicio de Cirugía Ortopédica y Traumatología, Consorci Sanitari Integral, Barcelona, España
Jorge Román Verdazco
Equipo de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Consorci Sanitari Integral de Barcelona. Sant Joan Despí, Barcelona
Alejandro Santamaría Fumas
Complex Hospitalari Moisès Broggi. Sant Joan Despí, Barcelona
Unidad de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Consorci Sanitari Integral (HSJDMB-HGH). Barcelona
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Marinel·lo J, Blanes JI, Escudero JR, Ibáñez V, Rodríguez J. Consenso de la SEACV sobre pie diabético. Angiología. 1997;5:193-230.
-
2International Diabetes Federation and International Working Group on the Diabetic Foot. Diabetes and Foot Care: time to act. The Netherlands: International Diabetes Federation; 2005.
-
3Frykberg RG, Zgonis T, Armstrong DG, Driver VR, Giurini JM, Kravitz SR, et al.; American College of Foot and Ankle Surgeons. Diabetic foot disorders. A clinical practice guideline (2006 revision). J Foot Ankle Surg. 2006 Sep-Oct;45(5 Suppl):S1-66.
-
4Sumpio BE, Armstrong DG, Lavery LA, Andros G. The role of an interdisciplinary team approach in the management of the diabetic foot. J Vasc Surg. 2010 Jun;51(6):1504-6.
-
5Pérez, A, Pedrero S, Montero A, Murillo O, Padrós C, Asunción J. El pie diabético: la perspectiva del cirujano ortopédico. Rev Pie Tobillo. 2014;XXVIII(1):7-15.
-
6Peters EJ, Lavery LA. Effectiveness of the diabetic foot risk classification system of the International Working Group on the Diabetic Foor. Diabetes Care. 2001;24:1442-7.
-
7Herr K, Shearman C, Jude EB. Managing complications of the diabetic foot. BMJ. 2009 Dec 2;339:b4905.
-
8Jude EB, Boulton AJM. End stage complications of diabetic neuropathy. Diabetes Rev. 1999;7:395-410.
-
9Young MJ, Boulton AJM, McLeod AF, Williams DR, Sonksen PH. A 6 multicentre study of the prevalence of diabetic peripheral neuropathy in the UK hospital clinic population. Diabetologia. 1993;36:150-4.
-
10Wagner FW Jr. The dysvascular foot: a system for diagnosis and treatment. Foot Ankle. 1981 Sep;2(2):64-122.
-
11Armstrong DG, Lavery LA, Harkless LB. Validation of a diabetic wound classification system. The contribution of depth, infection, and ischemia to risk of amputation. Diabetes Care. 1998 May;21(5):855-9.
-
12Schaper NC. Diabetic foot ulcer classification system for research purposes: a progress report on criteria for including patients in research studies. Diabetes Metab Res Rev. 2004 May-Jun;20 Suppl 1:S90-5.
-
13Lipsky BA, Berendt AR, Deery HG, Embil JM, Joseph WS, Karchmer AW, et al.; Infectious Diseases Society of America. Diagnosis and treatment of diabetic foot infections. Clin Infect Dis. 2004 Oct 1;39(7):885-910.
-
14Preventive Medicine for The Doctor in His Community. New York: McGraw Hill; 1965. p. 18.
-
15Bakker K, Apelquist J, Schaper NC. International Working Group on Diabetic Foot, Editorial board. Diabetes Metab Res Rev. 2012;28(Suppl 1):225-31.
-
16Aragón-Sánchez J. ¿Son útiles las unidades de pie diabético? [Are useful the diabetic foot units?]. Med Clin (Barc). 2014 Mar 4;142(5):208-10.
-
17Berengué M, Roura P. Diabetes mellitus. Guía de actuación en Atención Primaria. 1.ª edición. Madrid: SEMFYC; 2012.
-
18Blanes JI, Clará A, Lozano F, Alcalá D, Doiz E, Merino R, et al. Documento de consenso sobre el tratamiento de las infecciones en el pie diabético. Angiología. 2012;64:31-59.
-
19Document Marc de la Unitat Funcional de Diagnòstic i Tractament del Peu Diabètic. Hospital Universitari de Bellvitge. Generalitat de Catalunya, departament de salut. Octubre 2013.
-
20Edmonds ME, Blundell MP, Morris ME, Thomas EM, Cotton LT, Watkins PJ. Improved survival of the diabetic foot: the role of a specialized foot clinic. Q J Med. 1986 Aug;60(232):763-71.
-
21Martínez-Gómez DA, Moreno-Carrillo MA, Campillo-Soto A, Carrillo-García A, Aguayo-Albasini JL. Reduction in diabetic amputations over 15 years in a defined Spain population. Benefits of a critical pathway approach and multidisciplinary team work. Rev Esp Quimioter. 2014 Sep;27(3):170-9.
-
22Trautner C, Haastert B, Mauckner P, Gätcke LM, Giani G. Reduced incidence of lower-limb amputations in the diabetic population of a German city, 1990-2005: results of the Leverkusen Amputation Reduction Study (LARS). Diabetes Care. 2007 Oct;30(10):2633-7.
-
23Driver VR, Fabbi M, Lavery LA, Gibbons G. The costs of diabetic foot: the economic case for the limb salvage team. J Vasc Surg. 2010 Sep;52(3 Suppl):17S-22S.
-
24Fitzgerald RH, Mills JL, Joseph W, Armstrong DG. The diabetic rapid response acute foot team: 7 essential skills for targeted limb salvage. Eplasty. 2009;9:e15.
-
25Rubio JA, Aragón-Sánchez J, Lázaro-Martínez JL, Almaraz MC, Mauricio D, Antolín JB, et al. Unidades de pie diabético en España: conociendo la realidad mediante el uso de un cuestionario. Endocrinol Nutr. 2014;61(2):79-86.
-
26Lavery LA, Armstrong DG, Peters EJ, Lipsky BA. Probe-to-bone test for diagnosing diabetic foot osteomyelitis: reliable or relic? Diabetes Care. 2007;30(2):270-4.
-
27Lipsky BA, Pecoraro RE, Wheat LJ. The diabetic foot. Soft tissue and bone infection. Infect Dis Clin North Am. 1990 Sep;4(3):409-32.
-
28Kapoor A, Page S, Lavalley M, Gale DR, Felson DT. Magnetic resonance imaging for diagnosing foot osteomyelitis: a meta-analysis. Arch Intern Med. 2007;167(2):125-32.
-
29Nawaz A, Torigian DA, Siegelman ES, Basu S, Chryssikos T, Alavi A. Diagnostic performance of FDG-PET, MRI, and plain film radiography (PFR) for the diagnosis of osteomyelitis in the diabetic foot. Mol Imaging Biol. 2010 Jun;12(3):335-42.
-
30Eichenholtz SN. Charcot joints. Springfield, IL: Charles C. Thomas; 1966. pp. 3-8.
-
31Sanders LJ, Frykberg R. Diabetic neuropathic osteoarthropathy: the Charcot foot. En: Frykberg RG (ed.). The high risk foot in diabetes mellitus. New York, NY: Churchill Livingstone; 1993. pp. 297-336.
-
32Brodsky JW, Rouse AM. Exostectomy for symptomatic bony prominences in diabetic Charcot feet. Clin Orthop Relat Res. 1993;296:21-6.
-
33Besse JL, Leemrijse T, Deleu PA. Diabetic foot: the orthopedic surgery angle. Orthop Traumatol Surg Res. 2011 May;97(3):314-29.
-
34Armstrong DG, Nguyen HC, Lavery LA, van Schie CH, Boulton AJ, Harkless LB. Off-loading the diabetic foot wound: a randomized clinical trial. Diabetes Care. 2001 Jun;24(6):1019-22.
-
35Schaper NC. Diabetic foot ulcer classification system for research purposes: a progress report on criteria for including patients in research studies. Diabetes Metab Res Rev. 2004;20(Suppl. 1):S90-5.
-
36Lipsky BA. Medical treatment of diabetic foot infections. Clin Infect Dis. 2004;39(S2):S101-14.
-
37Koller A, Springfeld R, Engels G, Fiedler R, Orthner E, Schrinner S, Sikorski A. German-Austrian consensus on operative treatment of Charcot neuroarthropathy: a Perspective by the Charcot task force of the German Association for Foot Surgery. Diabet Foot Ankle. 2011;2.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Acuerdo de la Junta Directiva sobre el Congreso SEMCPT 2021
- Reflexiones y controversias sobre el <em>hallux valgus</em>. Actualización de conceptos
- Lesión sutil de Lisfranc tratada mediante fijación flexible con sutura intraósea con botón
- Osteotomía proximal del primer metatarsiano para <em>hallux valgus</em>, severos. Nuestra experiencia
- Lesiones de la articulación de Lisfranc: experiencia en el tratamiento quirúrgico
- Enfermedad de Müller–Weiss, ¿cómo hemos cambiado?
- Osteotomía del calcáneo percutánea: técnica quirúrgica y repaso de la bibliografía
- Comentario a “Osteotomía del calcáneo percutánea: técnica quirúrgica y repaso de la bibliografía”
- Protocolo diagnóstico y terapéutico de la SEMCPT para las complicaciones del pie diabético (1.ª parte)
- Memoria de actividad de estancia formativa en la Unidad de Pie y Tobillo del Consorci Sanitari Integral (L’Hospitalet de Llobregat, Barcelona)
- Revista de revistas
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista del pie y tobillo está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.