Papel de la fibrosis peridural en el dolor postoperatorio
Role of epidural fibrosis in postoperative pain following spinal surgery
Resumen:
Introducción: la fibrosis peridural ha sido tradicionalmente considerada una causa de dolor persistente tras la cirugía de columna, aunque su implicación clínica real sigue siendo motivo de debate.
Objetivo: analizar críticamente el papel de la fibrosis peridural en el dolor postoperatorio de columna y establecer criterios clínicos para su valoración y manejo.
Métodos: revisión narrativa de la literatura reciente y síntesis de la experiencia clínica, con integración de escalas diagnósticas, algoritmos de decisión y referencias bibliográficas actualizadas.
Resultados: la fibrosis peridural es un hallazgo común tras la cirugía, pero su correlación clínica es variable. En ausencia de compresión neural significativa y correlato clínico claro, no debe justificar por sí sola una recirugía.
Conclusiones: el dolor persistente posquirúrgico requiere una valoración multidimensional. La fibrosis peridural debe ser contextualizada dentro del abordaje integral del síndrome de espalda fallida.
Abstract:
Introduction: epidural fibrosis has traditionally been considered a cause of persistent pain after spine surgery, although its true clinical impact remains controversial.
Objective: to critically analyze the role of epidural fibrosis in postoperative spinal pain and establish clinical criteria for its assessment and management.
Methods: narrative review of the recent literature and synthesis of clinical experience, integrating diagnostic scales, decision-making algorithms, and updated scientific references.
Results: epidural fibrosis is a frequent finding after surgery, but its clinical correlation is variable. In the absence of significant neural compression and clear clinical correlation, it should not justify reoperation.
Conclusions: persistent postoperative pain requires a multidimensional assessment. Epidural fibrosis must be contextualized within the integral approach to the failed back surgery syndrome.
Introducción
El dolor persistente tras la cirugía de columna representa un problema clínico frecuente, con una incidencia que puede oscilar entre el 10 y el 40% según distintas series(1). Este dolor postoperatorio crónico, también denominado síndrome de espalda fallida (failed back surgery syndrome –FBSS–), genera un impacto significativo tanto en la calidad de vida del paciente como en el consumo de recursos sanitarios(2).
Durante años, la fibrosis peridural ha sido señalada como principal causa de este dolor persistente. Las primeras publicaciones que relacionaban hallazgos radiológicos con clínica posquirúrgica impulsaron esta hipótesis, especialmente a raíz de estudios realizados con resonancia magnética (RM)(3). Sin embargo, la correlación entre la presencia de fibrosis y la sintomatología dolorosa ha sido cuestionada en trabajos posteriores(4,5).
La fibrosis epidural es un fenómeno cicatricial fisiológico que aparece en la mayoría de los pacientes intervenidos. Estudios histológicos y por imagen han demostrado su elevada prevalencia incluso en pacientes asintomáticos(1). Esto ha motivado un cambio de paradigma en el abordaje del dolor tras cirugía: ya no se considera la fibrosis como causa única, sino como un hallazgo más dentro de un contexto clínico complejo.
En este nuevo enfoque multidimensional, cobran protagonismo factores neuropáticos, biomecánicos, funcionales y psicosociales. El dolor postoperatorio debe analizarse con herramientas clínicas específicas, como las escalas DN4 o Pain DETECT, validadas en lengua española y con buena sensibilidad y especificidad(6,7).
El objetivo de este artículo es revisar críticamente el papel de la fibrosis peridural en el dolor crónico posquirúrgico de columna, analizando la evidencia científica disponible, los principales sesgos históricos y proponiendo un algoritmo diagnóstico-terapéutico individualizado y actualizado.
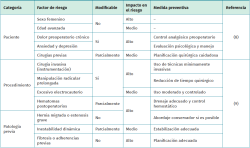
El dolor crónico tras la cirugía de columna suele ser el resultado de una compleja interacción entre factores relacionados con el paciente, el procedimiento quirúrgico y la respuesta biológica individual al trauma(8). Repasaremos los factores predisponentes a padecer dolor postoperatorio:
Recordatorio de las “3 P”: paciente, procedimiento y patología previa
Entre los factores relacionados con el paciente, destacan el sexo femenino, la edad avanzada, la presencia de dolor preoperatorio grave o crónico, el estado emocional (ansiedad/depresión) y los antecedentes de cirugías previas. También se ha relacionado una mayor propensión al dolor crónico con trastornos del sueño, inactividad física y estado inflamatorio basal elevado(8).
Desde el punto de vista del procedimiento quirúrgico, se ha documentado que las técnicas más invasivas (como la artrodesis multisegmentaria o la instrumentación posterior extensa), la manipulación radicular prolongada, el uso de electrocauterio extensivo o la presencia de hematomas postoperatorios contribuyen a una mayor tasa de fibrosis y sensibilización neural(9).
Finalmente, en cuanto a la patología previa, existe mayor riesgo en casos de hernias discales migradas, estenosis grave, fibrosis previa, cirugía de revisión, inestabilidad dinámica y síndromes de atrapamiento radicular. Estas condiciones predisponen a una mayor agresividad quirúrgica y, por tanto, a mayor reacción inflamatoria postoperatoria.
Factores modificables vs. no modificables
Es esencial distinguir entre factores modificables, como el control del dolor preoperatorio, la optimización nutricional y metabólica, y la técnica quirúrgica precisa; y los no modificables, como la genética del paciente, la edad o el sexo. Identificar adecuadamente los modificables permite actuar de forma preventiva mediante intervenciones adaptadas a cada perfil clínico.
En algunos estudios se ha propuesto incluso el desarrollo de escalas preoperatorias de riesgo, similares a las utilizadas en anestesia o cardiología, para anticipar la aparición de dolor crónico posquirúrgico y estratificar a los pacientes candidatos a protocolos específicos(8).
Influencia de la técnica quirúrgica y el abordaje
Una revisión comparativa de distintas técnicas de discectomía (microdiscectomía, endoscopia, laminectomía abierta, etc.) demostró que, aunque la tasa de éxito inicial era similar, las tasas de dolor residual crónico variaban significativamente según el tipo de abordaje, siendo más baja en técnicas mínimamente invasivas(9).
La elección de la técnica quirúrgica debería tener en cuenta no solo la patología anatómica, sino también el riesgo previsible de fibrosis o disfunción radicular persistente, especialmente en pacientes con antecedentes de múltiples intervenciones o comorbilidades inflamatorias (Tabla 1)(8,9).
¿Qué entendemos por espalda fallida?
El término “espalda fallida” ha evolucionado con el tiempo desde una concepción puramente mecánica a una visión más integradora. Tradicionalmente, se ha utilizado para describir el fracaso del tratamiento quirúrgico de la columna, pero actualmente engloba un síndrome clínico complejo, en el que el paciente continúa o reaparece con dolor después de uno o más procedimientos quirúrgicos sobre la columna vertebral(10).
Esta entidad clínica puede deberse a múltiples causas: desde una indicación inadecuada de la cirugía inicial, una selección deficiente del paciente, una técnica quirúrgica subóptima o complicaciones postoperatorias, hasta fenómenos fisiopatológicos como la sensibilización central, la fibrosis peridural, la inestabilidad biomecánica o trastornos neuropáticos(7,11).
En este contexto, el uso del término síndrome de espalda fallida (FBSS) ha sido cuestionado por su carga semántica negativa y su vaguedad diagnóstica. Se han propuesto denominaciones alternativas como “dolor persistente posquirúrgico de columna” o “síndrome de cirugía de espalda complicada”(10).
La International Classification of Diseases (ICD-11) ha incorporado el término “dolor crónico posquirúrgico” como categoría diagnóstica propia, desplazando progresivamente el concepto de FBSS y permitiendo una mejor codificación clínica y epidemiológica(11). Esta reclasificación permite distinguir entre dolor neuropático, nociceptivo y mixto, y facilita la investigación futura mediante criterios operativos más precisos.
El abordaje de esta entidad requiere una evaluación clínica exhaustiva que integre el análisis de la historia clínica, características del dolor, estudios de imagen actualizados y escalas funcionales. Solo desde una valoración multidimensional es posible orientar adecuadamente el tratamiento y evitar nuevas intervenciones ineficaces.
En la presente revisión, nos centramos en uno de los componentes más controvertidos en el origen del dolor posquirúrgico: la fibrosis peridural, revisando críticamente su relevancia clínica y el peso real que debería tener en la toma de decisiones terapéuticas.
La fibrosis peridural: ¿hallazgo o causa?
La fibrosis peridural es el resultado de un proceso fisiológico de cicatrización que se desencadena tras la agresión quirúrgica sobre los tejidos vertebrales y peridurales. Su formación responde a una secuencia inflamatoria, proliferativa y de remodelado, con implicación de mediadores como TGF-β, macrófagos, fibroblastos y colágeno(12).
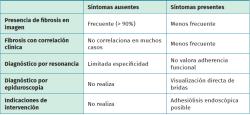
Históricamente, diversos estudios relacionaron la presencia de fibrosis peridural con la persistencia del dolor lumbar postoperatorio, particularmente en estudios con RM con contraste, lo que impulsó la teoría de que el atrapamiento de raíces por tejido cicatricial era la causa del dolor residual(2). Sin embargo, publicaciones más recientes y estudios controlados han cuestionado esta relación causal directa, evidenciando que muchos pacientes con fibrosis significativa permanecen asintomáticos(3,4) (Tabla 2)(13).
La discrepancia entre los hallazgos de imagen y la clínica del paciente ha llevado a clasificar la fibrosis como un hallazgo inespecífico en la mayoría de los casos. Su prevalencia en resonancias postoperatorias supera el 90% a los 3 meses de la intervención, especialmente en cirugías de abordaje posterior(14). Las Tablas 3 y 4 resumen algunos aspectos clave sobre la fibrosis peridural en relación con su diagnóstico por imagen, implicaciones clínicas y controversias actuales(15,16,17).
Evaluación clínica y herramientas diagnósticas
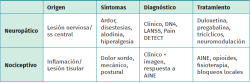
El abordaje diagnóstico del dolor persistente tras la cirugía de columna debe comenzar por una anamnesis detallada y una exploración física completa. Es imprescindible caracterizar el tipo de dolor (neuropático, nociceptivo o mixto), su localización, intensidad, factores desencadenantes y la evolución temporal desde la cirugía(18).
Especial mención recibe el dolor neuropático, ya que una proporción relevante de los pacientes intervenidos de columna desarrollan dolor crónico (sin alteraciones estructurales evidentes) en imagen. Este tipo de dolor se presenta como ardor, descargas eléctricas o disestesia persistente, y se etiqueta como dolor neuropático, con fisiopatología distinta al dolor mecánico o inflamatorio(14). El mecanismo a través del cual se desarrolla tras la cirugía está descrito en la bibliografía: el daño nervioso intraoperatorio, la tracción radicular o la isquemia local pueden desencadenar una neuropatía quirúrgica, seguida de un proceso de sensibilización central. Se observa desmielinización, alteraciones en la expresión de canales de sodio y activación de microglía en la asta dorsal, lo que puede perpetuar el dolor incluso tras restablecer la integridad anatómica(15).
Las escalas validadas como DN4 (una sensibilidad del 82% y una especificidad del 76%, con excelente fiabilidad test‑retest y consistencia interna en su versión española; punto de corte ≥ 4)(6), Leeds Assessment of Neuropathic Symptoms and Signs (LANSS) o Pain DETECT permiten identificar componentes neuropáticos con alta sensibilidad y especificidad, y son útiles para guiar el enfoque terapéutico(2). Asimismo, herramientas como el cuestionario de impacto del dolor crónico (Chronic Pain Grade) o el Índice de Discapacidad de Oswestry (ODI) ayudan a cuantificar la afectación funcional y la calidad de vida (Tabla 5).
Desde el punto de vista de la imagen, la RM con contraste sigue siendo la técnica de elección para evaluar alteraciones estructurales, recidiva de hernia discal, estenosis, fibrosis o colecciones(3). Sin embargo, como se ha mencionado anteriormente, la presencia de fibrosis peridural no implica necesariamente clínica dolorosa.
Técnicas más avanzadas como la neurografía por RM, la resonancia funcional o la electroneuromiografía pueden aportar información adicional en casos complejos(4). En determinados casos, el empleo de bloqueos diagnósticos puede ayudar a identificar el origen del dolor y a predecir la respuesta a terapias específicas.
Por último, es fundamental realizar una evaluación psicosocial y funcional completa del paciente. El dolor persistente posquirúrgico se ve frecuentemente influido por factores como la ansiedad, la depresión, trastornos del sueño o el catastrofismo, que deben ser identificados y abordados de forma precoz dentro de un enfoque multidisciplinario(5).
Estrategias preventivas y manejo multimodal
El desarrollo de dolor crónico postoperatorio no es inevitable. Diversos estudios señalan que hasta el 30-50% de los casos podrían prevenirse con una correcta planificación quirúrgica y un abordaje multimodal integral(19). Esto implica actuar desde la fase preoperatoria hasta la rehabilitación temprana, abordando factores físicos, psicológicos y sociales.
Identificación de factores de riesgo
La literatura recoge múltiples factores de riesgo independientes asociados al desarrollo de dolor persistente tras la cirugía espinal:
- Cirugías extensas o repetidas.
- Estenosis grave o discectomía agresiva.
- Ansiedad, depresión o catastrofismo preoperatorio.
- Tabaquismo, obesidad, comorbilidades mal controladas.
- Déficit funcional previo prolongado.
Intervenciones simples como dejar de fumar, ajustar la analgesia crónica, tratar cuadros depresivos o mejorar la condición física pueden tener impacto clínico positivo demostrado(19,20).
Medidas intraoperatorias
Durante la intervención, existen 3 estrategias claves para reducir el riesgo de fibrosis y dolor crónico:
- Minimizar la manipulación epidural: menor exposición = menor inflamación.
- Hemostasia rigurosa: se asocia a menor desarrollo de fibrosis cicatricial.
- Evitar resecciones amplias sin justificación clínica.
Además, se ha descrito un posible beneficio de técnicas como el uso de materiales absorbibles o barreras antifibróticas (ácido hialurónico, carboximetilcelulosa), aunque los resultados son inconsistentes y no están universalmente recomendados(17).
Protocolos ERAS en cirugía de columna
Los programas ERAS (Enhanced Recovery After Surgery) han ganado protagonismo también en cirugía espinal. Incluyen medidas como:
- Educación preoperatoria del paciente.
- Profilaxis multimodal del dolor.
- Reducción del ayuno preoperatorio y nutrición precoz.
- Deambulación temprana postoperatoria.
Estudios recientes indican que los protocolos ERAS reducen la estancia hospitalaria, el dolor postoperatorio y las tasas de complicaciones, promoviendo una recuperación funcional más rápida(20).
Profilaxis del dolor crónico
Algunos autores proponen el uso de estrategias preventivas dirigidas específicamente a evitar la cronificación, como:
- Iniciar precozmente pregabalina en pacientes de alto riesgo neuropático.
- Añadir dexmedetomidina intraoperatoria como coadyuvante.
- Monitorizar los niveles de dolor y ajustar la analgesia de forma dinámica.
- Uso de escalas de tipo Psychological Injury Risk Indicator (PIRI) o escala visual analógica (EVA) multidimensional.
Esta actitud proactiva permite modular la respuesta inflamatoria y neurogénica desde el inicio y es clave para reducir la necesidad de intervenciones invasivas posteriores(19,20,21).
Técnicas diagnósticas actuales
La evaluación del dolor crónico posquirúrgico se ha basado tradicionalmente en la RM con gadolinio, que permite identificar fibrosis peridural, recidiva discal, colecciones o estenosis residual. Entre las primeras clasificaciones relevantes destaca la de Ross, que propuso diferenciar fibrosis, hernia y mezcla de ambas mediante patrones de realce en RM, contribuyendo al concepto de atrapamiento radicular por tejido cicatricial(22).
Sin embargo, estudios posteriores han demostrado que la fibrosis detectada en RM no siempre se correlaciona con la clínica. Pacientes con fibrosis extensa pueden estar asintomáticos, mientras que otros con dolor persistente no muestran hallazgos relevantes. Esto ha conducido a una revaluación del papel diagnóstico de la RM en este contexto, enfatizando la necesidad de una correlación clínico-radiológica rigurosa(15).
En este escenario ha surgido la epiduroscopia como herramienta diagnóstica mínimamente invasiva que permite visualizar directamente las adherencias y estructuras radiculares. Su utilidad reside tanto en el diagnóstico diferencial (fibrosis densa con atrapamiento radicular vs. adherencias blandas sin compresión) como en su potencial terapéutico mediante lisis dirigida(16).
Estudios recientes han evidenciado que la epiduroscopia puede superar a la RM en sensibilidad para detectar adherencias clínicamente significativas y su uso se ha propuesto en casos seleccionados donde persiste dolor radicular sin hallazgos concluyentes en imagen convencional. No obstante, se trata de una técnica con disponibilidad limitada y cuyo uso debe reservarse a contextos específicos con indicación clara(23).
Abordaje terapéutico y algoritmos de decisión
El tratamiento del dolor persistente tras la cirugía de columna debe basarse en una aproximación escalonada, individualizada y multidisciplinaria. Es fundamental evitar decisiones precipitadas basadas únicamente en hallazgos radiológicos, especialmente cuando estos no guardan correlación clínica clara. La fibrosis peridural, si bien frecuente, no debe ser asumida automáticamente como causa del dolor residual sin una adecuada evaluación clínica y funcional(12).
Tratamiento conservador y farmacológico
La primera línea terapéutica es conservadora e incluye fisioterapia especializada, reeducación funcional, técnicas de control del movimiento, ergonomía y apoyo psicológico. El abordaje del miedo al movimiento (kinesiofobia) y la educación del paciente son pilares fundamentales para lograr la reintegración funcional(2).
En el tratamiento farmacológico, se debe considerar el tipo de dolor predominante:
- En el dolor neuropático, se recomienda el uso de gabapentinoides (gabapentina, pregabalina), antidepresivos tricíclicos o duales (amitriptilina, duloxetina).
- En el dolor nociceptivo, se indican antiinflamatorios no esteroideos, relajantes musculares o infiltraciones locales.
- Los opioides deben reservarse para casos refractarios, durante periodos cortos y bajo estricto control clínico(3).
Estudios recientes avalan el uso de duloxetina y pregabalina como tratamientos eficaces en el dolor neuropático posquirúrgico. En una serie retrospectiva, 19 de 24 pacientes mostraron mejoría con duloxetina tras cirugía espinal(24). Además, revisiones sistemáticas han mostrado que estos fármacos permiten reducir la necesidad de opioides en el tratamiento del dolor radicular persistente(25).
Las guías internacionales, como las del National Institute for Health and Care Excellence (NICE) y la Cochrane, sitúan a duloxetina, pregabalina y amitriptilina como fármacos de primera línea en el manejo del dolor neuropático crónico, con perfil de efectividad moderada y tolerabilidad aceptable(26).
Procedimientos intervencionistas y epiduroscopia
Cuando la respuesta al tratamiento conservador es insuficiente, puede plantearse el uso de técnicas intervencionistas:
- Bloqueos epidurales, tanto interlaminares como transforaminales, que tienen utilidad diagnóstica y terapéutica, especialmente para confirmar la radiculopatía por fibrosis(27).
- Radiofrecuencia, neuromodulación o infiltraciones con esteroides en casos seleccionados. La respuesta a estos procedimientos puede orientar el siguiente paso terapéutico.
- La epiduroscopia representa un avance relevante en este campo. Permite la visualización directa del espacio epidural, adhesiones y fibrosis, y posibilita una adhesiólisis dirigida con instilación local de fármacos. Su valor reside en su capacidad diagnóstica y en su potencial terapéutico en pacientes refractarios al tratamiento habitual.
Un grupo español liderado por Láinez et al.(28) ha demostrado resultados positivos con esta técnica, con mejoría significativa en las escalas de dolor y discapacidad, especialmente en pacientes con síndrome poslaminectomía.
Opciones quirúrgicas y técnicas avanzadas
La recirugía debe plantearse únicamente si existe evidencia estructural clara (estenosis, desplazamientos, pseudartrosis, etc.) y tras el fracaso documentado del tratamiento conservador. Su eficacia en fibrosis pura es limitada y puede aumentar el riesgo de complicaciones o fibrosis adicional(5).
En casos extremos, pueden valorarse procedimientos como:
- Implantación de bombas intratecales de fármacos para la administración continua de morfina o clonidina.
- Estimulación medular (neuromodulación) en dolor radicular intratable.
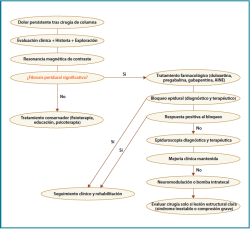
Estas técnicas requieren la valoración en unidades especializadas en dolor y la selección estricta del paciente(29) (Figura 1).
Conclusiones
- El dolor persistente tras la cirugía de columna representa un reto clínico complejo, multifactorial y de alta carga socioeconómica. Su origen puede derivar de alteraciones estructurales, fenómenos neuropáticos o componentes psicosociales, lo que exige un abordaje diagnóstico y terapéutico individualizado y multidisciplinario(2,3).
- Históricamente, la fibrosis peridural fue considerada la principal responsable del dolor residual. Sin embargo, la evidencia actual ha matizado esta asociación, demostrando que su presencia no siempre implica sintomatología y que debe interpretarse en conjunto con la clínica y las pruebas de imagen(14,15,16).
- Técnicas como la RM con gadolinio y la epiduroscopia han permitido un diagnóstico más preciso, al tiempo que abren nuevas vías terapéuticas(13,16).
- El tratamiento debe iniciarse con medidas conservadoras, incluyendo fisioterapia, reeducación funcional y tratamiento farmacológico orientado al tipo de dolor. Fármacos como duloxetina, pregabalina o gabapentinoides han demostrado eficacia moderada en el manejo del dolor neuropático posquirúrgico(25,26,30).
- Las técnicas intervencionistas, como las infiltraciones epidurales o la neuromodulación, ofrecen alternativas eficaces para pacientes seleccionados. La epiduroscopia, en particular, permite visualizar y tratar adherencias peridurales, actuando como herramienta diagnóstica y terapéutica en casos refractarios(4,16).
- Solo en presencia de una causa estructural bien definida y tras fracaso del tratamiento conservador debe plantearse la opción quirúrgica.
- Es necesaria una mayor inversión en investigación clínica de calidad y en estudios experimentales que permitan identificar biomarcadores o factores predisponentes a la fibrosis sintomática, así como validar nuevas estrategias de prevención, monitorización y tratamiento en el marco de una medicina personalizada.
Tablas
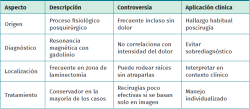
Tabla 4. Características clave de la fibrosis peridural. Aspectos fisiopatológicos, de imagen, tratamiento y controversia(15-17)
Figuras
Información del artículo
Cita bibliográfica
Autores
María Jesús Rodríguez Macías
Servicio de Ortopedia y Traumatología. Hospital FREMAP Majadahonda
Alicia Bartolomé Villar
Servicio de Radiología. Hospital FREMAP de Majadahonda. Madrid
Yolanda Contreras Citores
Servicio de Ortopedia y Traumatología. Hospital FREMAP Majadahonda
Enrique Nájera Vallejo
Hospital Fremap Majadahonda. Madrid
Ricardo Sánchez Hidalgo
Unidad de Miembro Superior. Hospital FREMAP. Majadahonda. Madrid
Gonzalo Hernández Seoane
Cirugía Ortopédica y Traumatología. Hospital Fremap Majadahonda. Madrid
Ignacio García Delgado
Servicio de Ortopedia y Traumatología. Hospital FREMAP Majadahonda
Fernando García de Lucas
Presidente de la SETLA
Unidad de Columna. Servicio de Cirugía Ortopédica y Traumatología. Hospital FREMAP Majadahonda. Madrid
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Fritsch EW, Heisel J, Rupp S. The failed back surgery syndrome: reasons, intraoperative findings, and long-term results. Spine. 1996;21(5):626-33.
-
2Baber Z, Erdek MA. Failed back surgery syndrome: current perspectives. J Pain Res. 2016;9:979-87.
-
3Songer MN, Ghosh L, Spencer DL. Effects of sodium hyaluronate on peridural fibrosis after lumbar laminotomy and discectomy. Spine. 1990;15(6):550-4.
-
4Mohi Eldin MM, Abdel Razek NM. Epidural Fibrosis after Lumbar Disc Surgery: Prevention and Outcome Evaluation. Asian Spine J. 2015;9(3):370-85.
-
5Ivanic GM, Pink PT, Schneider F, Stuecker M, Homann NC, Preidler KW. Prevention of epidural scarring after microdiscectomy: a randomized clinical trial comparing gel and expanded polytetrafluoroethylene membrane. Eur Spine J. 2006;15(9):1360-6.
-
6Pérez C, Gálvez R, Insausti J, Bouhassira D, Huelbes S, Margarit C, et al. Validity and reliability of the Spanish version of the DN4 questionnaire. Pain Practice. 2007;7(1):39-45.
-
7Chan CW, Peng P. Failed back surgery syndrome. Pain Med. 2011;12(4):577-606.
-
8Schug SA, Bruce J. Risk stratification for the development of chronic postsurgical pain. Pain Rep. 2017;2(6):e627.
-
9Wei FL, Tian L, Liu HP, Gao J, Yang Y, Ji Q. Eight surgical interventions for lumbar disc herniation: A network meta-analysis. Front Surg. 2021;8:679142.
-
10Liu B, Wu W, Wang Z, Hou W, Li H. Postoperative epidural fibrosis: challenges and opportunities – a review. Pain Res Manag. 2024;2024:11007250.
-
11Kose KC, Aydin A, Armagan R, Karabekir HS. Persistent pain after spinal surgery – a review. Pain Physician. 2022;25(1):1-10.
-
12Yang L, Zheng S, Ge D, Xia M, Li H, Tang J. LncRNA-COX2 inhibits fibroblast activation and epidural fibrosis by targeting EGR1. Int J Biol Sci. 2022;18(4):1347-62.
-
13Van Zundert J, Hartrick C, Patijn J, Huygen F, Mekhail N, van Kleef M. Evidence-based interventional pain medicine according to clinical diagnoses. Pain Pract. 2011;11(5): 423-9.
-
14Shen F, Ding J, Wang Y, Yin C, Han Z, Ren X, et al. Topical hemostatic agents in spinal surgery. Spine J. 2024;24(6):933-46.
-
15Rönnberg K, Lind B, Zöega B, et al. Peridural scar and its relation to clinical outcome: a randomised study on surgically treated lumbar disc herniation patients. Eur Spine J. 2008;17(12):1714-20.
-
16Urits I, Schwartz r, Brinkman J,Foster L et al. An Evidence Based Review of Epidurolysis for the Management of Epidural Adhesions in Low Back and Lower Extremity Pain. Pain Manag. 2019;9(5):465-77.
-
17Circi E, Atıcı Y, Barış A, Öztürkmen Y. Is tranexamic acid an effective prevention in the formation of epidural fibrosis? Histological evaluation in rats. J Korean Neurosurg Soc. 2023;66(5):503-10.
-
18Schug SA, Lavand’homme P, Barke A, Korwisi B, Rief W, Treede RD. The IASP classification of chronic pain for ICD-11: Chronic postsurgical or posttraumatic pain. Pain. 2019;160(1):45-52.
-
19Dorow M, Löbner M, Stein J, et al. Risk Factors for Postoperative Pain Intensity in Patients Undergoing Lumbar Disc Surgery: A Systematic Review. PLoS One. 2017;12(1):e0170303.
-
20Bansal T, Sharan A, Garg B . Enhanced Recovery After Surgery (ERAS) Protocol in Spine Surgery. World Neurosurg. 2022;166:e105-e119.
-
21Kaye AD, Chernobylsky DJ, Thakur P, et al. Dexmedetomidine in Enhanced Recovery After Surgery (ERAS) Protocols for Postoperative Pain. Curr Pain Headache Rep. 2020;24:21.
-
22Ross JS, Robertson JT, Frederickson RC, Petrie JL, Obuchowski N, Modic MT, deTribolet N. Association between peridural scar and recurrent radicular pain after lumbar discectomy: magnetic resonance evaluation. ADCON-L European Study Group. Neurosurgery. 1996;38(4):855-61; discussion 861-3.
-
23Bosscher HA, Heavner JE. Incidence and severity of epidural fibrosis after back surgery: An endoscopic study. Pain Pract. 2010;10(1):18-24.
-
24Liu J, Yang X, Jing W, et al. Clinical efficacy of duloxetine in the treatment of axial symptoms after posterior cervical spine surgery: a retrospective study. J Orthop Surg Res. 2023;18:496.
-
25Ling HQ, Yang Y, He W, et al. Comparative Efficacy and Safety of 11 Drugs as Therapies for Neuropathic Pain after Spinal Cord Injury: A Bayesian Network Meta-Analysis. Front Neurol. 2022;13:818522.
-
26Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015;14(2):162-73.
-
27MacVicar J, King W, Landers MH. The effectiveness of epidural steroid injections in the management of patients with radiculopathy: a systematic review. Spine J. 2013;13(3):332-40.
-
28Guauque CV, Pérez Anillo RD, Mesa Oliveros A. Manejo de adherencias epidurales y dolor lumbar crónico posquirúrgico con epiduroscopia. Repert Med Cir. 2022;31(3):242-50.
-
29Deer TR, Pope JE, Hanes MC, McDowell GC. Intrathecal Therapy for Chronic Pain: A Review of Morphine and Ziconotide as First-line Options. Pain Med. 2019;20(4):784-98.
-
30Tsuji O, Kosugi S, Suzuki S, et al. Effectiveness of Duloxetine for Postsurgical Chronic Neuropathic Disorders after Spine and Spinal Cord Surgery. Asian Spine J. 2021;15(5):650-8.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La hernia discal lumbar: abordaje multidisciplinario
- Enfoque inicial de la hernia discal lumbar. ¿Qué hay que hacer y qué no?
- Papel de la fibrosis peridural en el dolor postoperatorio
- Tratamiento quirúrgico de la hernia discal lumbar: indicaciones, momento, técnicas y resultados
- Tratamiento rehabilitador de la hernia discal lumbar. Evidencia científica
- Porque no todo es una hernia discal… A propósito de un caso clínico
- Cuando la hernia discal no explica todo: un caso clínico
Más en PUBMED
Más en Google Scholar


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.